Faire une solution saline ou 6 étapes Solution Hydroxyde

Une classe procédé approprié pour faire des solutions d'électrolyte de toute la force de Al-air ou piles à combustible microbienne si une source de chaleur est disponible. Le long de la façon dont nous allons en apprendre davantage sur le calcul des ratios, pourcentages et solubilité des produits chimiques inorganiques dans l'eau. De plus ces solutions peuvent être utilisées avec d'autres projets d'expérimenter avec les électrolytes rôle que jouent dans les piles à combustible et des batteries.
Une fois que vous avez une bouteille de solution saturée, vous pouvez prendre une partie de celui-ci et le diluer avec de l'eau distillée (ou même l'eau du robinet si elle est important de ne pas être trop précis) à un rapport en pourcentage que vous désirez de 1% à 99%, mais vous devez commencer avec une solution 100% afin de mélanger une dilution précise.
Alors que je vais mettre l'accent sur le sel de table commun les mêmes techniques peuvent être adaptées à un quelconque des composés inorganiques dans l'étape ultérieure.
Étape 1: Nomenclature

Étape 2: une solution Saturé




Une solution saturée est celui dans lequel le solvant (eau) a atteint l'équilibre entre le solvant dissous et non dissous. Qu'est-ce que ça veut dire? L'eau a absorbé tous les produits chimiques qu'elle peut contenir.
Le plus chaud de l'eau plus chimique, il peut contenir. Donc ce que nous allons faire est de chauffer l'eau (je suggère 100 degrés, mais nettement supérieure à la température ambiante fera ébullition est certainement pas nécessaire). J'ai trouvé que l'eau du robinet ne restait pas chaud assez longtemps et il était nécessaire d'utiliser une poêle et le poêle.
Une fois que l'eau a chauffé ajouter un peu de sel et remuer jusqu'à dissolution complète. Si vous utilisez une mesure à l'échelle de la cuisine, vous pouvez mesurer environ 100 g comme point de départ sinon il suffit de verser un peu et remuer. Répétez jusqu'à ce que le sel ne se dissout et cristaux de sel humides apparaissent sur le fond de la casserole (voir photo). Il n'y a pas de danger particulier à ajouter trop mais pas besoin d'en faire trop.
L'étape suivante parlera brièvement de la solubilité des divers produits chimiques ménagers tels que la lessive (hydroxyde de sodium) ou des sels d'Epsom, puis nous allons chercher à faire des solutions de différentes forces.
Étape 3: Combien chimique Ai-je besoin (solubilité)
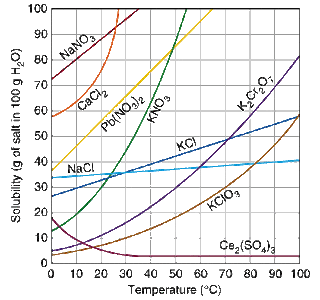
Le tableau ci-dessous fournit des données de base pour certains composés inorganiques communs. Le produit chimique est inscrit sur la gauche et la quantité de substance qui peut être absorbée par 100 ml d'eau à différentes températures est indiquée. Ainsi, par exemple du chlorure de sodium à 40 ° C (environ 100 °) tiendra 36,6 g de sel pour 100 ml, soit environ 183 g (environ 0,4 lb) dans 500 ml. La plupart d'entre eux sont facilement disponibles, souvent à votre magasin local magasin de matériel ou passe-temps avec des fournitures de chimie.
Étape 4: Pièces Est Pièces - Calcul Dilutions
Avant de faire une dilution réelle nous allons jeter un oeil à la façon de calculer des pourcentages différents. Maintenant, beaucoup d'entre vous immédiatement penser à la table dans l'étape de sauter et immédiatement précédente aux mathématiques simples. C'est un peu trompeur, comme nous le verrons à l'étape suivante une solution de 10% contient 10% en volume de solution saturée, et non 10% de sel. Le calcul réel est encore plus pénible que nous allons utiliser une méthode beaucoup plus simple pour obtenir notre solution désirée.
Donc, pour faire une dilution que nous aurons besoin de trouver un rapport correct de la solution saturée à l'eau « pure » et les mélanger ensemble.
La notion de « une partie » fait référence à l'aide de la même mesure pour la solution saturée et l'eau « pure ». Disons que vous tenez un petit verre dans votre main et vous le remplir avec la solution de sel de maître, vous avez maintenant « une partie » de la solution maître. Vous Dump dans un bocal, puis vous remplissez le même verre avec de l'eau et de l'ajouter au pot. Vous avez maintenant mélangé « une partie » solution de sel de maître sur « une partie de » l'eau distillée (ou 1: 1 rapport de mélange). Il en résulte une réduction de 50% de la concentration ou une solution à 50%. Si vous prenez une partie de solution de maître et d'ajouter deux parties d'eau, vous aurez le vent avec une solution d'eau salée 33,3% (1: 2 du rapport). Si vous prenez une partie de la solution maître et d'ajouter trois parties d'eau distillée, vous aurez une solution d'eau salée de 25% (ratio 1: 3). Si vous prenez une partie de solution de maître et d'ajouter quatre parties d'eau distillée, vous avez maintenant une solution d'eau salée de 20% (ratio 1: 4).
En utilisant la méthode « parties », si vous ajoutez simplement les deux chiffres du rapport « parties » ensemble et diviser ce en 100, il vous donnera le pourcentage de dilution finale. Par exemple, le rapport 1: 4 ajoute à « 5 ». Cinq divisé en 100 vous donne 20%. Que faire si vous voulez une solution d'eau salée de 10%? Simple. Quels sont les deux numéros de rapport (en commençant par « 1 » bien sûr) ajouter jusqu'à 10? Un plus neuf ou 1: 9 rapport de mélange. Une solution maître partie plus 9 parties d'eau distillée vous donnera une solution d'eau salée de 10%.
Voici un tableau qui montre les rapports les plus couramment utilisés. Utiliser une partie de solution saturée et un nombre approprié de mesures de l'eau pour obtenir la concentration de la solution souhaitée.


Maintenant, nous allons faire une solution à 10%. On sait de l'étape précédente que 1: 9 d'une solution saturée d'eau produit une solution à 10%. Nous savons aussi que nous voulons 500 ml de la solution (dans ce cas) donc nous avons juste besoin de calculer la taille de chaque « partie ».
Parce que nous savons que nous utilisons un 1: 9, il y aura 10 « parties », mais quelle taille devrait être chaque partie? Si l'on divise 500 ml par 10 nous pouvons voir que chaque partie sera de 50 ml.
Alors d'abord on mesure sur 1 « partie » de solution saturée ou 50 ml du maître ou d'une solution saturée et versez le tout dans la deuxième bouteille. Ensuite, nous mesurons sur 9 « parties » de l'eau. Depuis 9x50 = 450, nous savons que nous avons besoin de 450 ml d'eau dans notre tasse de mesure. Pour cela dans la deuxième bouteille, le bouchon et l'étiquette 10% Saline.
Étape 6: Récupération de l'excès de sel

Je ne voudrais pas mélanger ce retour avec un autre sel, croyez-moi des morceaux formeront. Cependant, le sel est comestible et n'a subi aucun dommage.
NE SOYEZ PAS UN IDIOT. GARDER LES PRODUITS CHIMIQUES ET SOLUTIONS HORS DE LA PORTÉE DES ENFANTS.