Isotopes et moyenne atomique de masse - Vidéo & Transcript Leçon
Quand vous buvez un verre d'eau, vous buvez en fait une combinaison d'eau lourde et de l'eau légère. Quelle est la différence? Est-il nocif? Cette vidéo vous expliquera la différence entre les deux types d'eau et entrer dans les détails sur la signification des différents isotopes d'éléments.
Différents types de pommes
Alors, ce qui les rend les pommes? Ils sont tous biologiquement nommés « Malus domestica ». Ils poussent sur les arbres. Ils ont des tiges. La liste continue. Mais ce qui les rend différents? Tout d'abord, le pommetier est très faible, il est de couleur rouge, et il a un goût assez aigre. Aux fins de cette leçon, nous allons donner une masse fictive de 1 uma, que nous appellerons la « unité de masse de pomme, » alors que la Golden Delicious est de taille moyenne, de couleur jaunâtre, un goût sucré, et nous allons donner à cette masse de 2 uma. Enfin, la Granny Smith est grand, vert, et un goût aigre. Nous donnerons cette pomme une masse de 3 uma, il pèse trois fois plus que le Crabapple. Ils sont tous semblables en ce qu'ils sont les pommes, mais ils ont beaucoup de caractéristiques différentes. Donc, si je devais vous demander quelle est la masse d'une pomme, que diriez-vous? 1 uma? 2? Ou 3 uma? Eh bien, tout dépend de quel type de pomme que vous faites référence.
Différents types de Atoms
L'hydrogène a trois isotopes principaux. Rappelez-vous que les isotopes ont le même nombre de protons mais un nombre différent de neutrons. L'isotope le plus commun de l'hydrogène n'a qu'un seul proton et zéro neutrons. Si les deux protons et neutrons ont une masse d'environ 1 uma (unité de masse atomique), la masse de cet atome serait d'environ 1 uma (juste la masse du proton). Cet isotope de l'hydrogène a un nom spécial, Protium, et il représente plus de 99,98% de tous les atomes d'hydrogène.
Protium est le principal isotope présent dans l'élément hydrogène.

Le prochain isotope le plus courant est appelé deuterium. Son noyau contient un proton et d'un neutron, de sorte qu'il a une masse d'environ 2 amu. Il représente moins de deux centièmes de pour cent de la population des atomes d'hydrogène.
Donc, si je devais vous demander ce que la masse d'un atome d'hydrogène est, vous devez savoir quel isotope je parlais - Protium, deuterium ou de tritium.
Bien que l'eau contient deux isotopes de l'hydrogène, il n'y a qu'une petite quantité de deutérium.

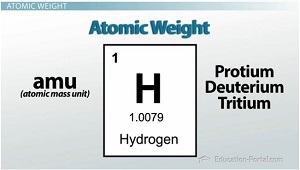
Poids atomique
Maintenant, je voudrais attirer votre attention sur le tableau périodique, plus précisément, le bloc d'hydrogène dans le coin supérieur gauche. Voir ce petit numéro ci-dessous le symbole chimique? On appelle cela la masse atomique moyenne (ou le poids atomique). Rappelez-vous les unités de masse atomique sont AMU (ou unités de masse atomique). Ainsi, la masse qui isotope du voyons-nous? Protium, deuterium ou de tritium? La réponse est tous.
déverrouiller contenu
Plus de 55 000 leçons dans tous les sujets majeurs
Accès GRATUIT pour 5 jours,
il suffit de créer un compte.
Le poids atomique du tableau périodique est calculée sur la base de l'abondance relative de chaque isotope de cet élément. Il est vraiment une moyenne pondérée de tous les isotopes d'origine naturelle. Ainsi, parce que la plupart de l'hydrogène a une masse de 1 uma, le poids atomique sur la table périodique va être très proche de 1; cependant, parce qu'il y a un petit peu d'isotopes d'hydrogène plus lourds, le poids représenté sera légèrement supérieure à 1 ou 1,0079 uma.
Un autre exemple est le lithium. Il y a deux isotopes principaux de lithium: lithium-6, qui a trois protons et trois neutrons et lithium-7, qui a trois protons et quatre neutrons. Selon le tableau périodique, le poids atomique est 6,941 uma. Sur cette base, quel isotope pensez-vous est le plus courant? Lithium-6 ou lithium-7? Parce que le nombre 6,941 est beaucoup plus proche de 7, il est susceptible d'être beaucoup plus au lithium-7 qui existe dans la nature. Gardez à l'esprit, tout comme les pommes et les atomes d'hydrogène, ces deux isotopes du lithium auront des comportements similaires. Leur seule différence est leur masse.
Le poids atomique d'un élément comprend le poids de l'ensemble des isotopes.
Isotopes ne sont que des variations du même élément; ils ont le même nombre de protons, et ils vont tous réagir de la même façon. La seule différence est qu'ils ont un nombre différent de neutrons, ce qui rendra leurs masses différentes. L'abondance de chaque type d'isotope est pris en compte lors du calcul de la masse atomique moyenne, ou le poids atomique, qui se trouve sur le tableau périodique.
Résultat d'apprentissage
Après avoir vu cette leçon, vous devriez être en mesure de reconnaître comment les isotopes sont des variantes du même élément, et comment cela est pris en compte lors du calcul de la masse atomique.
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.