L'expression d'un mutant négatif dominant innexin dans les neurones et les cellules gliales identifiées reveals_1
INTRODUCTION
MATÉRIAUX ET MÉTHODES
Animaux d'expérience
embryons sangsue utilisés dans ces expériences ont été obtenues à partir d'une verveine mixte Hirudo et Hirudo medicinalis colonie de reproduction maintenue dans notre laboratoire. Avant utilisation, elles ont été retirées de leurs cocons et conservés dans l'eau de source artificielle (0,5 g L -1 Instant Ocean, Aquarium Systems) à 22 ° C, et organisé selon les critères de Fernandez et le stent (1982). A cette température, le jour 0 (E0) est défini comme le jour du dépôt de cocon et 30 jours (E30) la date de naissance de l'animal juvénile du cocon. expériences d'expression ont été effectuées sur des embryons commençant à 12 jours à 17.
Expression et expression Neuronal Constructs
Immunocytochimie sur le mont entier Embryons
Anti-INX2 immunocytochimie a été réalisée sur des embryons monté entières en utilisant un poulet anticorps polyclonal anti-INX2 fait contre une séquence peptidique synthétique (YRTKPFVERVEDVESV) trouvé à proximité de l'extrémité C-terminale intracellulaire de INX2 et conjugué à la KLH par l'intermédiaire d'une cysteine N-terminal.
électrophysiologie
Culture de cellules
Analyses statistiques
Les mesures sont données en moyenne ± erreur standard. statistiques pour plusieurs significations données groupées ont été déterminées par une analyse de variance dans Excel suivie par les tests de Student apparié t de chercher des similitudes et des différences entre les groupes.
Exprimé Tagged Formulaire neuronal Innexins punctas avec distributions différentielles et tailles
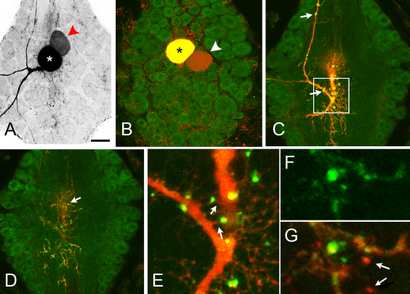
L'expression de Hve-inx1-EGFP ou Hve-inx2-EGFP ne modifie pas la dorsale tactile (T) de couplage de colorant de la cellule à un réseau d'interneurones. (A) l'injection dans un Neurobiotin dorsal T neurone sensoriel milieu de l'embryogenèse (astérisque) révèle qu'il est normalement colorant couplé à un ensemble de petits interneurones 7-10 (têtes de flèches rouges). L'emplacement, le nombre exact et le degré de passage de colorant sont quelque peu variables selon les préparations à ces stades embryonnaires. Lorsque INX1-EGFP (B, C) ou INX2-EGFP (D, E) a été exprimée dans la cellule T dorsale, l'étiquetage Neurobiotin a révélé une répartition apparemment normale de petit-soma des cellules couplé colorant (têtes de flèches blanches en C, E). Les deux protéines marquées formées lacrymaux dans les tonnelles des cellules mais principalement le long des processus majeurs. Notez que les plaques INX2 semblent être plus, moins nombreux et plus répandus que ceux de INX1 et beaucoup semblaient adjacentes aux points de branchement (flèches. Quantification de la figure 3). Bar = 100 um.
Une question importante est de savoir si nous avons abordé l'expression d'un transgène marqué par une cellule qui exprime aussi le innexin conduit à des propriétés de manière endogène des cellules anormales. Premièrement, nous avons comparé les mandrins de contrôle-INX1 exprimant la catégorie des neurones et l'âge adapté, tel que révélé par injection de colorants fluorescents ou coexpression de mCherry, et nous avons trouvé aucune différence manifeste dans leur taille, ou des motifs de ramification caractéristiques (données non présentées). Deuxièmement, nous avons injecté le colorant GJ-Neurobiotin passant dans les neurones exprimant transgènes de se demander si cela a affecté le modèle de couplage à d'autres cellules. Pour les deux neurones que nous avons testé (T, N = 9; Rz, N = 5), le colorant a révélé la structure normale de passage de colorant [cf. Figues. 1 (A, B) et 2 (A, C, E)].
Lorsque Innexin transgènes sont co-exprimés dans Neurones, INX1 et INX14 punctas Overlap Intensivement, considérant INX1 et INX6 punctas Ne pas
Nous avons ensuite dosé de deux transgènes coexpression marqués différemment dans le même neurone pour étudier la position relative des deux protéines. Tout d'abord, cependant, nous avons exprimé INX1-EGFP et INX1-mCherry ensemble pour tÉMoiN; effets possibles des balises que cela pourrait affecter hexamère concevable oligomérisation et confirmer que la même protéine innexon fait en effet co-localiser dans les cellules. Dans toutes les préparations examinées (N = 3), les points lacrymaux ont été observés à se chevaucher dans les deux canaux fluorescents [Fig. 4 (A-D)].
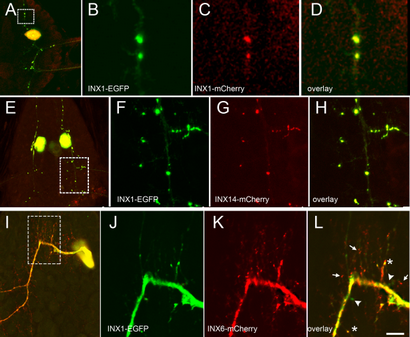
Coexpression de deux transgènes INX révèle différentes occurrences de colocalisation dans lacrymaux tout au long de tonnelles neuronales. (A) de vue en faible grossissement d'une cellule T coexprimant INX1-EGFP et INX1-mCherry. (B-D) vue à fort grossissement de la zone encadrée dans le panneau A montrant que lorsque le même transgène a été exprimé avec deux marqueurs fluorescents différents, colocalisation a été observée. (E) à faible grossissement vue d'un ganglion avec deux cellules T exprimant chacun INX1-mCherry et INX14-EGFP. (F-H) de points de vue à fort grossissement de la zone encadrée dans le panneau E, montrant que INX1 et 14 co-localisent. (I) à faible grossissement vue d'un neurone Pagode antérieur (AP) exprimant INX1-EGFP et INX6-mCherry. (JL) Vue à fort grossissement de la zone encadrée dans le panneau I, ne montrant que colocalisation partielle, avec la plupart des lacrymaux de INX1 étant concentrés à proximité ou dans les processus majeurs de la cellule AP et la INX6 étant plus largement répartis dans l'axe, en particulier dans les processus de terminaux de petite taille. L indiquent en Asterisks des exemples possibles de INX1 et INX6 colocalisation, des exemples de pointes de flèches INX1 sans INX6 et des flèches indiquent des exemples de INX6 sans fluorescence INX1. Bar = dix um, sauf dans les panneaux A, E et I, où il est 100 um.
Mutation d'un Proline très Conservée à Leucine Crée une protéine INX1 avec des propriétés négatives dominantes
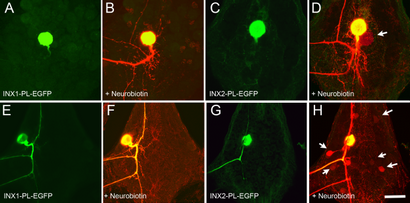
Expression de INX1-PL dans la cellule Rz et T couplage de colorant supprime à son homologue, mais l'expression de INX2-PL ne fonctionne pas. A. Embryonic cellules exprimant le mutant Rz Hve-inx1-PL-EGFP transgène. Notez que la protéine marquée est présente dans le corps diffusément cellulaire et de la région initiale de l'arbre, mais pas lacrymaux peut être détectée. B. Comme cellules en A, mais rempli de Neurobiotin et colorées avec streptavidine-Alexa 568 pour visualiser l'arbre, ce qui montre une anatomie normale à ce stade embryonnaire. Les deux canaux de fluorescence sont affichés. Il n'y a pas de diffusion de colorant détectable à d'autres neurones. C. cellulaire exprimant le Embryonic Rz mutant Hve-inx2-PL-EGFP transgène. Comme dans A, la protéine marquée est observée principalement dans et près du corps cellulaire, mais lacrymaux sont absents. D. Comme B, mais dans ce cas, le Neurobiotin a diffusé au controlatéral homolog (flèche), ce qui indique un couplage persistant GJ. E. Une cellule T exprimant le transgène Hve-inx1-PL-EGFP échoue également à former lacrymaux. (F) Neurobiotin remplissage révèle un arbre de cellule T normale, mais ne parvient pas à montrer le couplage aux petits interneurones [cf. Fig. 2 (C)]. G. Exprimé protéines INX2-PL-EGFP a également échoué à former lacrymaux. (H) couplage Neurobiotin apparemment normal aux petits interneurones a été observée dans cette cellule (flèches). Bar = 75 um.
Que cet effet de couplage dans les cellules Rz et T est spécifique à INX1-PL est indiqué par son absence lorsque le gliale muté innexin -PL HVE inx2 a été ectopique exprimé dans ces mêmes neurones. Comme la INX1-PL protéine mutante, INX2-PL n'a pas produit lacrymaux fluorescent dans les neurones quand il a été exprimé dans la cellule Rz, mais contrairement à INX1-PL, normal colorant couplage avec le controlatéral homolog a été observée en présence de INX2 voir -PL [ Fig. 5 (C, D) avec la Fig. 1 (A, B)]. De même, colorant couplage normal interneurones de cellules T a été observée lorsque -PL HVE inx2 a été exprimé dans les cellules T [cf. Figues. 5 (G, H) et 2 (A, C, F)].
En résumé, ces résultats montrent que INX1-PL agit sélectivement comme un dominant négatif dans les cellules qui expriment INX1 façon endogène (neurones), et INX2-PL agit sélectivement comme un dominant négatif dans les cellules qui expriment INX2 façon endogène (cellules gliales).
Inx1-PL Agit comme un dominant négatif en bloquant l'exportation de INX1 protéines à la surface cellulaire
Comme décrit ci-dessus, exprimée protéine mutante INX1-PL-EGFP est diffuse localisée dans le corps de la cellule et dans les régions proximales de l'arbre d'un neurone expérimental, mais il ne semble pas en grappe lacrymaux. Qu'est-ce qui arrive à la INX1 endogène normale de ce neurone? Parce que le couplage de colorant est également supprimé, une explication possible est que la protéine mutante bloque également la formation de lacrymaux par le innexin normal. Manquant un anticorps INX1, on n'a pas pu observer directement la distribution du INX1 endogène. Au lieu de cela, nous avons exprimé le transgène INX1-mCherry normale avec le mutant transgène INX1-PL-EGFP dans plusieurs neurones (N = 3). Comme le montre la paire de neurones sur la figure 7 (A-C), les deux gènes sont traduits en protéines marquées, et les deux sont localisées de manière diffuse au soma et proximale arbre, mais ni les agrégats de protéines dans puncta partout dans la cellule. Une explication parcimonieuse à cette observation est que la protéine de INX1 endogène est également empêché la formation de points lacrymaux par le mutant, empêchant ainsi la formation de GJ et la suppression de la diffusion de colorant sur les autres cellules avec lesquelles elle est normalement couplé. Les observations décrites ci-dessus pour l'expression INX2-PL dans les cellules gliales sont compatibles avec cette explication. Immunocoloration avec notre anticorps spécifique à INX2, qui se lie à la fois le type sauvage et les protéines mutantes INX2, montre que les lacrymaux de INX2 normaux sont absents lorsque INX2-PL est exprimé [cf. Fig. 6 (B, E)], et le couplage de colorant est abolie [cf. Fig. 6 (C, F)].
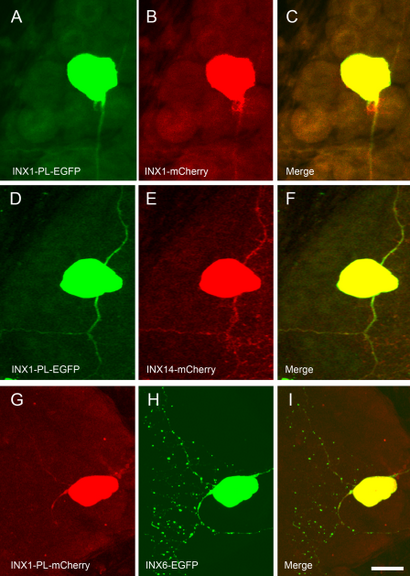
Coexpression de Inx1-PL avec d'autres transgènes innexin normales. (A-C) coexpression de INX1-pLEGFP (A) et (côté de droite) INX1-mCherry (B) dans un (côté gauche) cellule T et un neurone AP conduit à une absence de protéines GJ de INX1 de type sauvage. (D-F) coexpression de INX1-PL-EGFP (D) et INX14-mCherry dans une cellule T a également supprimé puncta INX14-mCherry dans le neurone. (GI) En revanche, lorsque INX1-PL-mCherry (G) et INX6-EGFP (H) ont été exprimées dans une cellule de pression ventrale (VP), le transgène INX6 de type sauvage encore formé puncta de premier plan à travers l'axe du neurone . Barre d'échelle = 50 um.
L'expression de la INX1-PL Transgène en culture cellulaire indique que la protéine INX1-PL n'Exporté à la surface cellulaire
Sur la base de ces expériences, nous pouvons conclure que la protéine mutante INX1-PL GJ est exprimé, mais il n'est pas exporté vers la membrane plasmique des cellules S2R +, apparaissant au lieu d'accumuler dans les organes internes, peut-être les cellules réseau trans-Golgi.
INX1-PL Agit comme un dominant négatif de INX1 et INX14 mais pas de INX6
Pour vérifier si la propriété négative dominante de INX1-PL ne concerne que l'ensemble des innexins exprimés qui interagissent probablement avec INX1, nous avons ensuite analysé pour déterminer les effets de INX1-PL sur un innexin qui n'a pas exclusivement colocalisent avec INX1, INX6 [voir Fig. 4 (IL)]. Le résultat de la coexpression INX6-EGFP et INX1-PL-mCherry dans une série de neurones était cohérente: la formation de lacrymaux par INX6 n'a pas été affecté [Fig. 7 (G-I)]. Nous concluons donc qu'un mutant PL d'un acte de innexin comme un mutant dominant à d'autres innexins qui interagissent et colocalisent avec elle, mais il ne fonctionne pas innexins qui forment lacrymaux dans d'autres régions de l'arbre de la même cellule.
DISCUSSION
Emplacements des Innexin punctas dans un Neuronal Arbor Correlate avec participation à particulier Coupled Networks
Expression de cellules spécifiques PL Mutants découple de leurs réseaux normaux, ce qui indique que le chargement normal de Exprimé Innexins avec un autre Interact
- La protéine mutante INX1-PL semble se concentrer sur le corps cellulaire des cellules de sangsues et dans les cellules S2R + ne semble pas se rendre à la membrane cellulaire.
- INX1-PL empêche également coexprimé protéine INX1-WT marqués d'atteindre la membrane plasmique neuronale et la formation de plaques ou de jonction. Par extension, nous supposons qu'il fait la même chose à la protéine endogène INX1, ce qui correspond à la perte de couplage écart jonctionnelle par le neurone expérimental. Nous pouvons observer cette interférence présumée directement lorsque nous exprimons INX2-PL dans les cellules gliales en raison de la disponibilité d'un anticorps INX2: pas de plaques INX2 contenant endogènes sont détectés dans une cellule gliale exprimant INX2-PL.
- INX1-PL expression bloque également la formation de plaques par une autre protéine GJ normalement exprimé dans les neurones, INX-14, qui co-localise dans puncta avec INX1 de type sauvage.
- INX1-PL expression n'affecte pas co-exprimé dans les neurones marqués INX6, qui forme encore des plaques largement réparties dans l'axe du neurone expérimental. INX6 n'a pas, pour la plupart, co-localisent avec INX1 de type sauvage.
information sur les articles
S'il vous plaît noter: Wiley-Blackwell n'est pas responsable du contenu ou de la fonctionnalité de toute information fournie par les support auteurs. Toutes les requêtes (autres que le contenu manquant) doivent être adressées à l'auteur de l'article.
LES RÉFÉRENCES
contenu connexe
Articles liés à celui que vous consultez
Littérature citant
- Nombre de fois cité. 7