Le brome, l'élément chimique - réaction, l'eau, les utilisations, les éléments, le métal, le gaz, le numéro, le nom
Est membre Bromine de la famille d'halogène. Les halogènes sont les éléments qui composent groupe 17 (VIIA) du tableau périodique. Le tableau périodique est un tableau qui montre comment les éléments sont liés les uns aux autres. Les halogènes sont également connus comme les faiseurs de sel. Le fluor, le chlore, le brome, l'iode et forment des sels d'astate lorsque combiné chimiquement avec un métal.
Bromine a été découvert, à peu près en même temps en 1826, par deux hommes, le chimiste allemand Carl Lowig (1803-1890) et le chimiste français Antoine-Jérôme Balard (1802-1876). Alors que Balard a annoncé sa première découverte, Lowig avait tout simplement pas terminé ses études de l'élément quand Balard a fait son annonce.
NUMÉRO ATOMIQUE
35
MASSE ATOMIQUE
79,904
FAMILLE
Group 17 (VIIA)
Halogène
Découverte et nommage
Les composés de brome étaient connus depuis des centaines d'années avant que l'élément a été découvert. L'un des plus célèbres de ces composés est rose tyrien, appelée aussi pourpre royale. (Tyrien vient du mot de pneu, une ancienne cité phénicienne.) Seules les personnes très riches ou la royauté pouvaient se permettre d'acheter des tissus teints avec Tyrian pourpre. Il a été obtenu à partir d'un mollusque (poisson coquille) se trouve sur les rives de la mer Méditerranée (une grande étendue d'eau bordée par l'Europe, l'Asie et l'Afrique).
En 1825, L # XF6, perruque inscrite à l'Université de Heidelberg en Allemagne pour étudier la chimie. Il a poursuivi une expérience qu'il avait commencé à la maison dans laquelle il a ajouté le chlore à l'eau de source. L'addition d'éther au mélange qui a produit une belle couleur rouge. L # XF6, perruque suspectait qu'il avait découvert une nouvelle substance genre. Un professeur l'a encouragé en suggérant qu'il étudie la substance plus en détail.
Comme ces études progressaient, Balard a publié un rapport dans un journal chimique qui a annoncé la découverte du nouveau brome élément. L'élément avait toutes les propriétés de L # XF6; perruque # x0027; s nouvelle substance. Les deux chimistes avaient fait la découverte à peu près en même temps! Balard, cependant, est crédité comme découvreur de brome, parce que les scientifiques reconnaissent la première personne à publier ses conclusions.
En grec, le mot Bromos moyen # X0022; puanteur # x0022; (Forte odeur offensive). Bromine la hauteur de la description. L'odeur est intense et très irritant pour les yeux et les poumons.
Chimistes ont constaté que le brome appartenait à la famille des halogènes. Ils savaient qu'il avait des propriétés similaires à d'autres halogènes et placé en dessous du fluor et du chlore dans le tableau périodique.
Propriétés physiques
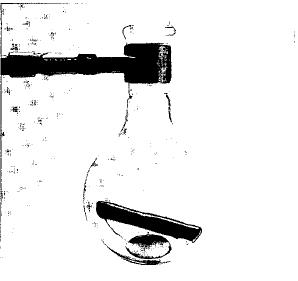
Récipient de laboratoire contenant les solides, liquides, et les états de gaz de brome.
Propriétés chimiques
Le brome est un élément très réactif. Bien qu'il soit moins réactif que le fluor ou le chlore, il est plus réactif que l'iode. Il réagit avec de nombreux métaux, parfois très vigoureusement. Par exemple, avec le potassium, il réagit de façon explosive. Le brome combine même avec des métaux relativement non réactifs, tels que le platine et le palladium.
Présence dans la nature
Le brome est un élément modérément abondant. Son abondance dans la Terre # x0027; la croûte est estimée à environ 1,6 à 2,4 parties par million. Il est beaucoup plus abondant dans l'eau de mer où elle est estimée à environ 65 parties par million.
Dans certaines régions, l'abondance de brome est encore plus élevé. Par exemple, la mer Morte (qui borde Israël et la Jordanie), a un niveau élevé de sels dissous. L'abondance de brome, il est estimé à 4.000 parties par million. La salinité ou la teneur en sel, est si élevé que rien ne vit dans l'eau. Voilà pourquoi on l'appelle la mer Morte.
Deux isotopes naturels existants de brome existent, le brome-79 et le brome-81. Les isotopes sont deux ou plusieurs formes d'un élément. Les isotopes diffèrent les uns des autres en fonction de leur nombre de masse. Le nombre écrit à droite de l'élément # x0027; le nom est le nombre de masse. Le nombre de masse représente le nombre de protons et de neutrons dans le noyau d'un atome de l'élément. Le nombre de protons détermine l'élément, mais le nombre de neutrons dans l'atome d'un élément quelconque peut varier. Chaque variation est un isotope.
Au moins 16 isotopes radioactifs de brome sont connus également. Un isotope radioactif est celui qui se brise et dégage une certaine forme de rayonnement. Les isotopes radioactifs sont produits lorsque de très petites particules sont cuites à des atomes. Ces particules se collent dans les atomes et les rendre radioactifs.
Pas isotope de brome a toute utilisation commerciale importante.
La salinité ou la teneur en sel, est si élevé que rien ne vit dans l'eau. Voilà pourquoi on l'appelle la mer Morte.
Extraction
La méthode utilisée par Lowig et Balard pour recueillir le brome continue d'être utilisé aujourd'hui. Le chlore est ajouté à l'eau de mer contenant du bromure de sodium ou le bromure de potassium. Le chlore est plus actif que le brome et le brome remplace dans la réaction:
L'utilisation la plus importante de brome est aujourd'hui dans la fabrication de matériaux ignifuges. De nombreux matériaux utilisés dans la fabrication des vêtements, des tapis, des rideaux et des stores opaques sont inflammables, et si une flamme les touche, ils brûlent très rapidement. Les chimistes ont appris à fabriquer des matériaux plus résistants aux incendies en les faisant tremper dans un composé de brome. Les couches composites les fibres du matériau. Le composé brome peut également être chimiquement incorporé dans le matériau.
Les composés bromes utilisés dans des retardateurs de flamme sont souvent compliquées. Un tel composé est appelé tris (dibromopropyle), le phosphate ((Br 2 C 3 H 5 O) 3 PO). Cependant, ce composé a été trouvé être cancérogène (substance causant le cancer). Son utilisation, par conséquent, a été sévèrement restreint.
Environ 20 pour cent de l'ensemble de brome est utilisé dans des puits de forage. le bromure de calcium (CaBr2), le bromure de sodium (NaBr), ou le bromure de zinc (ZnBr 2) sont ajoutés au puits pour augmenter l'efficacité du processus de forage.
Le brome est également important dans la fabrication de pesticides, les produits chimiques utilisés pour tuer les insectes nuisibles. Le bromure de méthyle (CH 3 Br) a été utilisée depuis des années pour traiter les terres cultivées. Le bromure de méthyle est pulvérisée sur la surface ou injecté directement dans le sol.
Certains bromure de méthyle évapore toujours dans l'air où il endommage la couche d'ozone. L'ozone (O 3) les filtres gaz sur une partie du rayonnement ultraviolet (UV) du soleil. le rayonnement UV provoque des cancers de la peau, les coups de soleil et des dommages aux plantes et organismes fragiles.
L'utilisation la plus importante de brome est aujourd'hui dans la fabrication de matériaux ignifuges.
le dibromure d'éthylène (C 2 H 4 Br 2) est un composé de bromure ajoutée à l'essence au plomb. Le chef de file dans # X0022; l'essence au plomb # x0022; est le plomb tétraéthyle (Pb (C 2 H 5)) 4). Il aide les combustibles brûlent plus proprement et maintient les moteurs de voitures de # X0022;. Frapper # x0022; # X0022; Knocking # x0022; est un son cognant métallique répétitif qui se produit quand il y a des problèmes d'allumage

Les composés bromés augmentent l'efficacité du processus de forage dans le puits de pétrole.
avec une voiture # x0027; s moteur. # X0022; Knocking # x0022; réduit l'efficacité d'un moteur de voiture.
Mais l'essence au plomb dégage sans plomb, car il brûle. Sans plomb est un élément très toxique qui cause des dommages au système nerveux. DBE est ajouté à réagir avec le plomb libre et le convertir en un composé sûr.
dibromure d'éthylène ne résout pas complètement le problème. Certains sans plomb échappe encore dans l'atmosphère. L'essence au plomb a été interdit aux États-Unis depuis de nombreuses années, mais est encore utilisé dans d'autres pays.
L'élément le plus populaire pour la purification de l'eau publique et des piscines utilisées pour être le chlore. Les composés bromés sont devenus plus populaires pour leurs bactéries supérieures pouvoir tuer.
Effets sur la santé
Le brome est toxique en cas d'inhalation ou d'ingestion. Il peut endommager le système respiratoire et le système digestif, et peut même causer la mort. Il peut également causer des dommages en cas de déversement sur la peau.
Lisez également l'article de Wikipedia à propos Bromine