PH de l'eau - Systèmes de mesure de l'environnement
Qu'est-ce que le pH?
Le pH est une valeur déterminée sur la base d'une échelle définie, similaire à la température. Cela signifie que le pH de l'eau ne soit pas un paramètre physique qui peut être mesurée en tant que concentration ou en quantité. Au lieu de cela, il est un chiffre compris entre 0 et 14 définissant la façon dont un corps d'eau acide ou basique est le long d'une échelle logarithmique ¹. Plus le nombre est élevé, plus l'eau est acide. Plus le nombre, il est plus basique. Un pH de 7 est considéré comme neutre. L'échelle logarithmique signifie que chaque nombre inférieur à 7 est 10 fois plus acide que le nombre précédent lorsque le compte à rebours. De même, lorsque l'on compte au-dessus de 7, chaque numéro est 10 fois plus basique que le précédent numéro ².
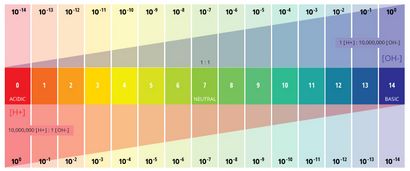
pH représente la « puissance de l'hydrogène » ³. La valeur numérique du pH est déterminée par la concentration molaire des ions hydrogène (H +) ³. Cela se fait en prenant le logarithme négatif de la concentration en H + (-log (H +)). Par exemple, si une solution a une concentration en H + de 10 -3 M, le pH de la solution sera -log (10 -3), qui est égal à 3.
Acides et bases
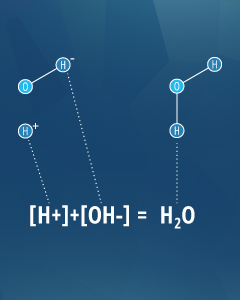
les paires acide-base peuvent neutraliser les uns les autres comme H + et OH- faire dans cette équation.
Basic ou alcaline
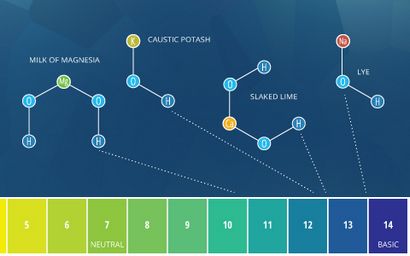
Des exemples courants d'alcalis comprennent le lait de magnésie - Mg (OH) 2, de la potasse caustique - KOH, la chaux éteinte / eau de chaux - Ca (OH) 2, et de la soude caustique (soude caustique) - NaOH.
Les termes « alcalines » et « base » désignent à peu près la même chose. D'après la définition de Bronsted-Lowry, fondamental décrit toute substance qui réduit la concentration en ions hydrogène et augmente le pH de l'eau, ou en d'autres termes, une base ⁴. Alcalin provient alcalin, qui se réfère à des composés ioniques (sels) contenant un métal alcalin ou des éléments de métaux alcalino-terreux qui forment des ions hydroxyde lorsqu'ils sont dissous dans l'eau ⁵. les sels alcalins sont très fréquents et se défont facilement. En raison des ions hydroxyde qu'ils produisent (qui augmentent le pH), les bases sont des bases. Certaines sources définissent une quelconque base soluble comme un ⁵ alcalin. En tant que tel, les bases solubles peuvent être décrits comme « base » ou « alcalin ». Cependant, les bases insolubles (tels que l'oxyde de cuivre) ne doivent être décrits comme base, non alcalin.
Alcalinité et le pH de l'eau
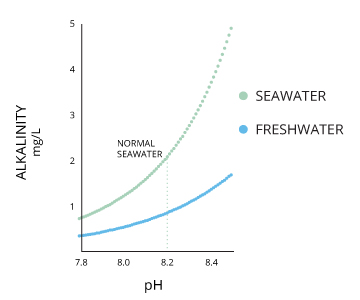
Alcalinité et le pH sont directement liés à 100% de saturation d'air.
Les unités de pH et Alcalinité
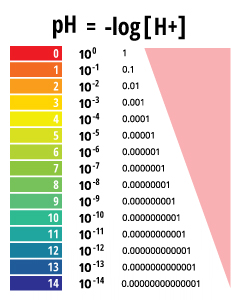
des valeurs de pH sont déterminés sur une échelle logarithmique.
Toutefois, étant donné l'échelle du pH est logarithmique, en essayant de moyenne deux valeurs de pH serait mathématiquement incorrect. Si une valeur moyenne est nécessaire, il peut être signalé comme une médiane ou une plage, non pas comme un simple calcul ¹⁰.
L'alcalinité peut être rapporté en mg / L ou microéquivalents par litre (meq / L). Quand en mg / L, on se réfère au carbonate (CO3 2-), bicarbonate (HCO3 -) ou des concentrations de carbonate de calcium (CaCO3), bien que le carbonate de calcium est la plus courante ¹¹.
Pourquoi est-pH important?
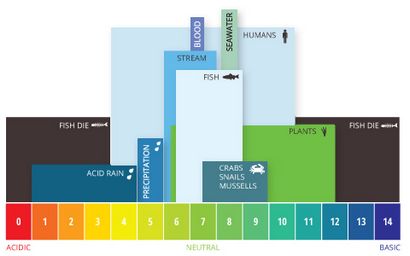
les niveaux de pH de l'eau. Les niveaux de pH optimales pour les poissons sont de 6,5 à 9,0. En dehors des plages optimales, les organismes peuvent devenir stressés ou mourir.
Si le pH de l'eau est trop élevée ou trop faible, les organismes aquatiques qui y vivent vont mourir. pH peut également affecter la solubilité et la toxicité des produits chimiques et des métaux lourds dans le ¹² de l'eau. La majorité des créatures aquatiques préfèrent une gamme de pH de 6,5 à 9,0, bien que certains peuvent vivre dans l'eau avec des niveaux de pH en dehors de cette plage.
Comme les niveaux de pH se éloignent de cette gamme (haut ou bas), il peut insister sur les systèmes animaux et réduire l'éclosion et les taux de survie. Le plus à l'extérieur de la plage optimale de pH une valeur est élevée, plus les taux de mortalité. Plus une espèce sensible, plus affectée est par des changements de pH. En plus des effets biologiques, les niveaux de pH extrêmes augmentent généralement la solubilité des éléments et de composés, ce qui rend les produits chimiques toxiques plus « mobile » et l'augmentation du risque d'absorption par la vie aquatique ¹³.
Les espèces aquatiques ne sont pas les seuls touchés par le pH. Bien que les humains ont une plus grande tolérance pour les niveaux de pH (niveau potable varient 4-11 avec une irritation gastro-intestinale minime), il reste une préoccupation ¹⁴. des valeurs de pH supérieures à 11 peuvent provoquer des irritations de la peau et des yeux, comme le fait un pH inférieur à 4. Une valeur de pH inférieure à 2,5 entraîne des dommages irréversibles aux garnitures de la peau et des organes ¹⁴. La baisse des niveaux de pH augmentent le risque de métaux toxiques mobilisés qui peuvent être absorbés, même par les humains, et des niveaux supérieurs à 8,0 ne peuvent pas être efficacement avec le chlore désinfectées, entraînant d'autres risques indirects ¹⁴. En outre, les niveaux de pH en dehors de 06/05 à 09/05 et peuvent endommager la corrosion des tuyaux et d'autres systèmes, ce qui accroît la toxicité de métal lourd.
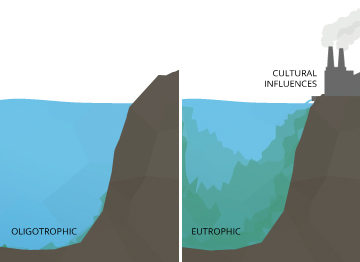
Une légère augmentation des niveaux de pH peut causer un lac oligotrophe (riche en oxygène dissous) pour devenir eutrophe (manque d'oxygène dissous).
pH Même des changements mineurs peuvent avoir des effets à long terme. Un léger changement dans le pH de l'eau peut augmenter la solubilité du phosphore et autres nutriments - les rendant plus accessibles pour la croissance des plantes ¹⁰. Dans un lac oligotrophe, ou d'un lac pauvre en éléments nutritifs et riche en niveaux d'oxygène dissous, cela peut provoquer une réaction en chaîne. Avec des éléments nutritifs plus accessibles, les plantes aquatiques et les algues se développent, ce qui augmente la demande en oxygène dissous. Cela crée un lac eutrophe, riche en éléments nutritifs et la vie végétale, mais faible en concentrations d'oxygène dissous. Dans un lac eutrophe, d'autres organismes vivants dans l'eau deviendront stressés, même si les niveaux de pH sont restés dans la plage optimale.
Les facteurs qui influent sur le pH de l'eau
Il y a plusieurs facteurs qui peuvent affecter le pH dans l'eau, à la fois naturel et artificiel. La plupart des changements physiques se produisent en raison d'interactions avec la roche environnante (formes particulièrement carbonate) et d'autres matériaux. Le pH peut également varier avec la précipitation (en particulier les pluies acides) et des eaux usées ou des décharges minières ¹³. En outre, les concentrations de CO2 peuvent influer sur les niveaux de pH.
Dioxyde de carbone et le pH
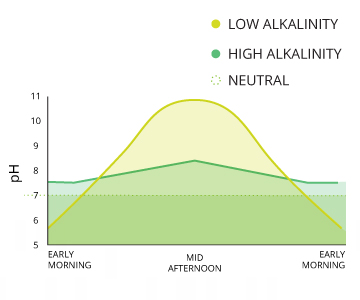
les niveaux de pH peuvent fluctuer d'un jour en raison de la photosynthèse et de la respiration dans l'eau. Le degré de changement dépend de l'alcalinité de l'eau.
Bien que le dioxyde de carbone dans l'eau existe à l'état dissous (tel que l'oxygène), on peut également réagir avec l'eau pour former de l'acide carbonique:
CO2 + H2O <=> H2CO3
H2CO3 peut alors perdre une ou l'autre de ses ions hydrogène:
H2CO3 <=> HCO3 - + H + .... HCO3 - <=> CO3 2- + H +

Les équations ci-dessus expliquent aussi pourquoi la pluie a un pH d'environ 5,65 ¹⁵. Comme les gouttes de pluie tombent dans l'air, ils interagissent avec des molécules de dioxyde de carbone dans l'atmosphère. Cela crée H2CO3 dans les gouttes de pluie, abaisser la valeur du pH de la pluie ¹⁷. Un niveau de pH de 5,65, bien que les pluies acides acide, n'est pas considéré. Naturel, la pluie ou de la neige non polluée devrait avoir des niveaux de pH près de 5,6, en supposant une concentration atmosphérique normale de CO2 de 0,0355% ¹⁵. Les pluies acides a besoin d'un pH inférieur à 5,0 ²¹.
Influences pH naturel
matériaux carbonatés et le calcaire sont deux éléments qui peuvent tampons des changements de pH dans l'eau. Le carbonate de calcium (CaCO3) et d'autres bicarbonates peuvent se combiner à la fois avec des ions hydrogène ou hydroxyle pour neutraliser pH¹⁸. Lorsque minéraux de carbonate sont présents dans le sol, la capacité tampon (alcalinité) d'eau est augmentée, en maintenant le pH de l'eau proche de la neutralité, même lorsque des acides ou des bases sont ajoutés. des carbonates supplémentaires au-delà de ce qui peut rendre l'eau neutre légèrement basique.

Les carrières de calcaire ont des niveaux de pH plus élevés en raison des matériaux de carbonates dans la pierre.

La foudre peut abaisser le pH de la pluie.

Man-Made influenceurs pH
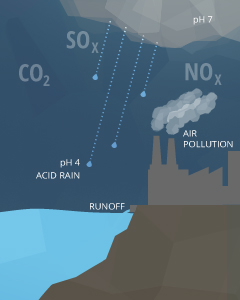
La pollution dans l'air, le sol ou directement dans l'eau peuvent affecter le pH.
Les niveaux de pH typiques

niveaux de pH minimum recommandé pour la vie aquatique.
niveaux de pH typiques varient en raison des influences de l'environnement, en particulier alcalinité. L'alcalinité de l'eau varie en raison de la présence de sels et de carbonates dissous, ainsi que la composition minérale du sol environnant. En général, plus l'alcalinité, plus le pH; la partie inférieure de l'alcalinité, plus le pH ⁶. La plage de pH recommandé pour la plupart des poissons est compris entre 6,0 et 9,0 avec une alcalinité d'au moins 20 mg / L, avec des niveaux de CaCO3 idéal entre 75 et 200 mg / L ²⁰.
organismes océaniques comme clownfish et les coraux ont besoin de niveaux de pH plus élevés. les niveaux de pH inférieurs à 7,6 causeront des récifs coralliens pour commencer à faire effondrer l'absence de carbonate de calcium ³⁹. espèces d'eau douce sensibles comme le saumon préfèrent les niveaux de pH entre 7,0 et 8,0, devenant gravement en détresse et la souffrance des dommages physiologiques dus aux métaux absorbés à des niveaux inférieurs de 6,0 ⁴⁰.
A un pH Seawater environ 8,2, bien que cela peut varier entre 7,5 à 8,5 en fonction de sa salinité locale. des niveaux de pH augmentent avec la salinité jusqu'à ce que l'eau atteigne la saturation du carbonate de calcium (CaCO3) ¹⁶. Les océans ont généralement une alcalinité plus élevée en raison de la teneur en carbonate et ont donc une plus grande capacité de mémoire tampon des ions hydrogène libres ²⁷.
lacs d'eau douce, des étangs et des cours d'eau ont généralement un pH de 6 à 8 en fonction du sol environnant et la roche ²¹. Dans les lacs profonds où stratification (stratification) se produit, le pH de l'eau est généralement plus élevée (7/5 à 8/5) à proximité de la surface inférieure et (06/05 à 07/05) à de plus grandes profondeurs ¹⁰. Certains états, comme l'Alaska, tentent de maintenir un niveau de pH pour la qualité de l'eau. La norme qualité de l'eau de l'Alaska exige des niveaux de pH entre 6,5 et 8,5 pour protéger les nombreuses populations de saumon dans l'état ⁴⁰.
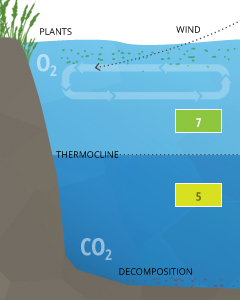
La stratification peut provoquer des niveaux de pH dans une masse d'eau diffèrent au-dessus et en dessous du cline.
Considérations Stratification
La stratification est généralement causée par des différences de température dans un corps d'eau, où chaque couche d'eau ne se mélange pas avec les couches supérieures ou inférieures à ³⁷. Ces couches sont séparées par clines, connus sous le nom de thermocline (divise de température) ou chemoclines (gradients de chimie). Chemoclines peuvent être basés sur l'oxygène, la salinité ou d'autres facteurs chimiques qui ne traversent pas le Cline, tels que le dioxyde de carbone. En raison de l'influence du CO2 sur le pH de l'eau, la stratification peut provoquer des niveaux de pH diffèrent sur un Cline.
Adaptabilité
Bien que les niveaux de pH idéal pour les poissons sont 7-8 (sang de poisson a un pH de 7,4) ²⁰, la plupart des poissons peuvent adapter au niveau du pH de leur environnement (6,0-9,0) tant qu'il n'y a pas de fluctuations importantes. Une variation considérable est considéré comme un changement de pH de 1,4 (haut ou bas) ²². Pour les poissons d'eau salée, le pH de l'eau doit rester entre 7,5 et 8,5 ⁹.
Les niveaux et les conséquences de pH inhabituelles

madrépores commencent à blanchir et à se détériorer sous forme de carbonate et la chute des niveaux de pH.
Les effets néfastes deviennent perceptibles lorsque le pH de l'eau est inférieure à 5,0 ou élever au-dessus de 9,6. effets indésirables liés à l'acidification sont plus prononcés dans les poissons d'eau salée en raison de leur adaptation à un pH plus élevé. Lorsque le pH est inférieur à un niveau optimal, les poissons deviennent plus sensibles aux infections fongiques et autres dommages physiques ¹⁶. Comme le pH de l'eau chute, la solubilité du carbonate de calcium est réduite, ce qui inhibe la croissance de la coquille dans les organismes aquatiques ¹⁶. En général, la reproduction des poissons est affectée à des niveaux de pH inférieur à 5,0 et de nombreuses espèces (comme les poissons d'eau de mer ou poissons d'eau douce sensibles comme achigan à petite bouche) quitte la région ²¹. Les poissons commencent à mourir lorsque le pH tombe en dessous de 4,0 ¹².

Les métaux lourds sont plus toxiques à des niveaux de pH inférieurs.
Les faibles niveaux de pH peuvent favoriser la solubilité des métaux lourds ¹². Comme le niveau d'ions hydrogène augmente, des cations de métaux tels que l'aluminium, le plomb, le cuivre et le cadmium sont libérés dans l'eau au lieu d'être absorbés dans le sédiment. Étant donné que les concentrations de métaux lourds augmentent, leur toxicité augmente également. L'aluminium peut limiter la croissance et la reproduction tout en augmentant les taux de mortalité à des concentrations aussi faibles que 0,1 à 0,3 mg / L ²². En outre, les métaux peuvent être mobilisés pris en charge par les organismes au cours de la respiration, causant des dommages physiologiques ²². Ceci est particulièrement préjudiciable aux espèces telles que ¹³ la truite arc en ciel.
De l'autre côté du spectre, les niveaux de pH élevés peuvent endommager les branchies et la peau des organismes aquatiques et causer la mort à des niveaux plus de 10,0. Alors que certains cichlidés africains se développent à des niveaux de pH élevé (jusqu'à 9,5), la plupart des poissons ne peuvent pas les tolérer. La mort peut se produire même à des niveaux typiques (9.0) si l'ammoniac est présent dans l'eau ²¹. A des niveaux de pH faibles et neutres, l'ammoniac se combine avec l'eau pour produire un ion ammonium:
NH3 + H2O <=> NH4 + + OH -

algues à faible pH tolérant peuvent former des fleurs qui peuvent tuer le lac.
Ammonium, NH4⁺, est non toxique et n'affectera pas la vie aquatique. Cependant, à des niveaux de pH de 9, l'équation inverse et de l'ammoniac est libéré dans l'eau ²². L'ammoniac, NH3, est extrêmement toxique pour les organismes aquatiques, et que le pH augmente, les taux de mortalité augmentent avec la concentration NH3.
Du côté de l'écosystème, les mousses peuvent commencer à envahir un plan d'eau que le pH de l'eau est inférieure à 5. Dans les lacs eutrophes, algues pH tolérant peut dominer, entraînant les niveaux de pH à diurnes extrêmes haut et bas, formant la prolifération d'algues qui peuvent tuer le lac ¹⁶.
Alcaline et acide Lakes
Répartis dans le monde sont un certain nombre de lacs avec des niveaux de pH inhabituels. lacs alcalins, aussi connu comme les lacs de soude, ont généralement un niveau de pH compris entre 9 et 12. Ceci est souvent dû à une teneur élevée en sel (mais pas tous les lacs de sel a un pH élevé). Ces lacs ont des concentrations élevées de minéraux, les sels dissous en particulier le sodium, le calcium, les carbonates de magnésium et les bicarbonates ²⁸. Selon le lac, les borates, les sulfates et d'autres éléments (généralement des ions forts de base) peuvent également être présents ²⁹. lacs alcalins se forment lorsque la seule sortie de l'eau est l'évaporation, laissant les minéraux derrière pour accumuler ³⁰. Ces minéraux forment souvent des colonnes de gisements minéraux, connus sous forme de colonnes de tuf. De nombreux lacs alcalins sont une ressource commerciale pour le carbonate de soude et de potasse, tandis que d'autres sont des destinations touristiques populaires pour leurs propriétés curatives « magiques » (en raison de la teneur en minéraux).
Soap Lake à Washington est un lac alcalin supposé avoir des propriétés curatives (Crédit photo: Steven Pavlov via Wikipedia Commons)
dépôts de soufre et de fer à l'un des lacs acides de Dallol.
Les lacs d'acide à Dallol en Ethiopie sont le résultat de lixiviation acide des volcans voisins. Le soufre et le fer dans l'eau laissent des dépôts jaunes et de couleur rouille autour du bord de l'eau.
Avec un niveau de pH inférieur à 5,0, peu d'organismes peuvent vivre dans les lacs acides. Cependant, il y a une exception notable: la dace Osorezan ou dace japonais. Ce poisson se nourrit dans les eaux acides du lac Osorezan, se reposer confortablement à un pH de 3,5, et nage dans les eaux que de pH neutre pour se reproduire ³⁴.
L'acidification des océans
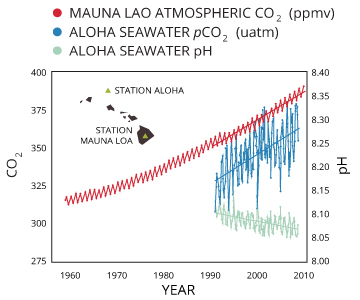
Comme mentionné dans la section « dioxyde de carbone et du pH », CO2 supplémentaire augmente le nombre d'ions d'hydrogène dans l'eau, la réduction du pH:
CO2 + H2O <=> H2CO3 ... H2CO3 <=> (H +) + HCO3⁻
A des niveaux de pH compris entre 6,4 et 10,33, une partie de ces ions d'hydrogène à fixer des ions carbonate ²²:
(H +) + CO3 2- <=> HCO3 -
CO2 + H2O + CO3²⁻ <=> 2HCO3⁻
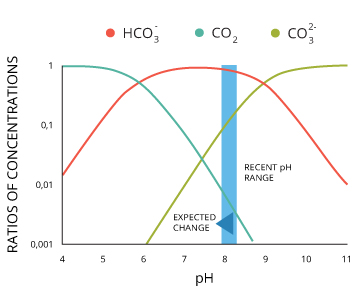
Des niveaux élevés de CO2 rendent également plus difficile de maintenir des coquilles actuels en raison de la baisse des niveaux de pH et de la concurrence pour ³⁵ carbonate.
En outre, la saturation de l'air de l'eau est basée sur des pressions partielles de la loi de Henry. Comme les niveaux de CO2 dans l'augmentation de l'air, le fait trop leur pression partielle. Cela réduit la pression partielle de l'oxygène, ce qui réduit ses niveaux de saturation et de contribuer à des conditions hypoxiques (O2 faible) ³⁵.