Pont de sel (protéine et supramoléculaire)
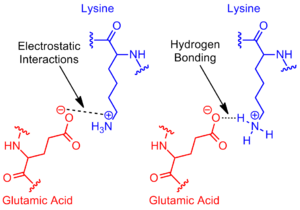
Figure 1. Exemple de pont salin entre les acides aminés acide glutamique et la lysine démontrant une interaction électrostatique et une liaison hydrogène
En chimie. un pont de sel est une combinaison de deux interactions non covalentes: la liaison hydrogène et les interactions électrostatiques (figure 1). Ceci est le plus souvent observé pour contribuer à la stabilité de la conformation repliée entropique défavorable des protéines. Bien que les interactions non-covalentes sont connus pour être des interactions relativement faibles, les petites interactions de stabilisation peuvent ajouter jusqu'à apporter une contribution importante à la stabilité globale d'un conformère. [1] Non seulement les ponts de sel dans les protéines, mais ils peuvent également être trouvés dans la chimie supramoléculaire. La thermodynamique de chacun sont explorés au moyen de procédures expérimentales pour évaluer la contribution de l'énergie libre du pont de sel à l'énergie libre totale de l'état.
ponts salins trouvés dans les protéines Modifier
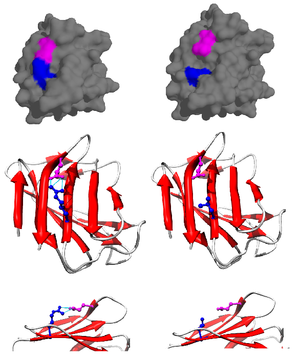
Figure 2. forme de type sauvage (à gauche) et muté (à droite) de la lamine A (LMNA, APB: 1IFR). Normalement, l'arginine 527 (bleu) forme pont de sel avec le glutamate 537 (magenta), mais la mutation R527L provoque la perte de la charge négative complémentaire et de déstabilisation structure. Au niveau du phénotype ce manifeste avec chevauchement dysplasie mandibuloacral et le syndrome de progeria. [2]
Le pont de sel se présente le plus souvent à partir du carboxylate anionique (RCOO -) soit de l'acide aspartique ou l'acide glutamique et l'ammonium cationique (RNH3 +) de la lysine ou la guanidine (RNHC (NH2) 2 +) de l'arginine (figure 2). [1] Bien que ceux-ci sont à chaînes latérales ionisables, tels que l'histidine, d'autres résidus les plus courants. tyrosine. et la sérine peut également participer, en fonction des facteurs extérieurs perturbatrices de leur pKa. La distance entre les résidus participant au pont de sel est également cité comme étant importante. La distance requise est inférieure à 4 Å (400 pm). Les acides aminés supérieure à cette certaine distance ne sont pas considérés comme formant un pont de sel. [3] En raison des nombreuses chaînes latérales ionisables d'acides aminés trouvés tout au long d'une protéine, le pH auquel une protéine est placé est cruciale pour sa stabilité.
Des procédés pour quantifier la stabilité du pont de sel Modifier

Figure 3. Un pont de sel dans lysozyme T4 entre l'acide aspartique (Asp) au niveau du résidu 70 et une histidine (His) au niveau du résidu 31
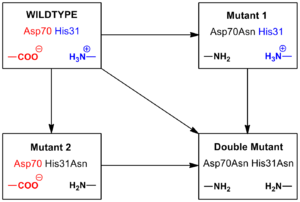
Figure 4. La mutagenèse de pont de sel de lysozyme T4 entre 70 et Asp 31 Son
Une fois que les mutants ont été établis, deux méthodes peuvent être utilisées pour calculer l'énergie libre associée à un pont de sel. Un procédé implique l'observation de la température de fusion de la protéine de type sauvage par rapport à celle des trois mutants. La dénaturation peut être contrôlée par un changement de dichroïsme circulaire. Une réduction de la température de fusion indique une réduction de la stabilité. Ceci est quantifié par une méthode décrite par Becktel et Schellman où la différence d'énergie libre entre les deux est calculée par AT AS. [5] Il y a quelques problèmes avec ce calcul et ne peuvent être utilisés avec des données très précises. [Citation requise] Dans l'exemple du lysozyme T4, AS du type pseudo-sauvage a déjà été rapporté à un pH de 5,5 de sorte que la différence de température de point médian de 11 ° C à ce pH, multiplié par le AS rapporté de 360 cal / (mol · K ) (1,5 kJ / (mol · K)), on obtient une variation d'énergie libre d'environ -4 kcal / mol (-17 kJ / mol). Cette valeur correspond à la quantité d'énergie libre contribué à la stabilité de la protéine par le pont de sel.
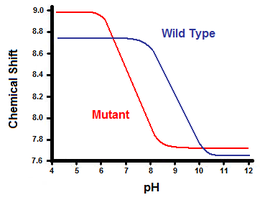
Figure 5. Courbe de titrage entre le type sauvage (bleu) et le mutant (rouge)
Le second procédé utilise la spectroscopie par résonance magnétique nucléaire pour calculer l'énergie libre du pont de sel. Un titrage est effectué, tout en enregistrant le déplacement chimique correspondant aux protons du carbone adjacent au groupe carboxylate ou ammonium. Le point médian de la courbe de titrage correspondant au pKa. ou le pH où le rapport de protonés: molécules déprotoné est de 1: 1. En continuant avec l'exemple du lysozyme T4, une courbe de titrage est obtenue par l'observation d'un changement dans le proton C2 de l'histidine 31 (Figure 5). La figure 5 montre le déplacement de la courbe de titrage entre le type sauvage et le mutant dans lequel Asp70 est Asn. Le pont de sel formé entre le Asp70 déprotoné et His31 protonés. Cette interaction provoque le changement vu dans pKa His31. Dans le dépliée protéine de type sauvage, où le pont de sel est absent, His31 est rapporté pour avoir un pKa de 6,8 dans H2 0 tampons de force ionique modérée. La figure 5 montre un pKa du type sauvage de 9,05. Cette différence de pKa est prise en charge par l'interaction des His31 avec Asp70. Pour maintenir le pont de sel, His31 va tenter de garder son proton aussi longtemps que possible. Lorsque le pont de sel est perturbé, comme dans le mutant D70N, le pKa se déplace à une valeur de 6,9, beaucoup plus proche de celle de His31 à l'état déplié.
La différence de pKa peut être quantifiée afin de refléter la contribution du pont de sel à l'énergie libre. En utilisant l'énergie libre de Gibbs. AG = -RT ln (Keq), où R est la constante universelle des gaz, T est la température en kelvins, et Kéq est la constante d'équilibre d'une réaction à l'équilibre. La déprotonation de His31 est une réaction d'équilibre avec un acide Keq spécial connu comme la constante de dissociation acide. Ka. His31-H + ⇌ His31 + H +. Le pKa est ensuite liée à Ka par ce qui suit: pKa = -log (Ka). Calcul de la différence d'énergie libre du type sauvage mutant et peut maintenant être fait en utilisant l'équation d'énergie libre, la définition de la PKA. les valeurs de pKa observée et la relation entre les logarithmes naturels et des logarithmes. Dans l'exemple de lysozyme T4, cette approche a donné une contribution calculée d'environ 3 kcal / mol à l'énergie libre globale. [4] Une approche similaire peut être pris avec l'autre participant dans le pont de sel, tel que Asp70 dans l'exemple de lysozyme T4, en contrôlant son changement de pKa après mutation de His31.