Une méthode simple pour la taille de synthèse contrôlée des grappes d'or stables oligomériques
introduction
Il y a une utilisation croissante de nanoparticules d'or dans des essais biologiques 9,10- et chimiques. Malgré la disponibilité de nombreuses sources pour l'achat de nanoparticules d'or, ils viennent à un prix considérable par rapport au coût de la synthèse de la maison. Le coût élevé de nanoparticules disponibles dans le commerce fait la synthèse de la maison souhaitable. Notre procédure implique la synthèse de nanostructures par petites oligomériques en 2-3 nm sous-unités d'or sphériques. Avoir tous les avantages de nanoparticules d'or classiques, nanostructures sont oligomériques choix préféré en ce qui concerne les taux de perméabilité ou de filtration des mesures parce que leur structure modulaire imite la structure des protéines.
À l'heure actuelle, les approches les plus communes à la maison dans la synthèse de nanoparticules d'or impliquent la réduction du chlorure d'or (HAuCl4) dans des conditions aqueuses 11,12. Réduction de HAuCl4 avec des réactifs communs réducteurs tels que le borohydrure de sodium (NaBH4) ou le citrate de sodium, permet la production de nanoparticules sphériques 13. Les nanoparticules d'or synthétisés par ces procédés sont limités dans leur gamme de dimensions utiles, car ils deviennent sensibles à la présence de des sels dans des tampons biologiques, leurs diamètres de coeur augmentent. Un procédé a déjà été décrit pour la synthèse de nanoparticules jaunes de diamètre 2-3 nm de la réduction de HAuCl4 avec du thiocyanate de sodium dans des conditions alcalines 14,15.
Nous décrivons ici une modification de cette méthode qui produit un oligocluster de raisin comme des nanoparticules jaunes sans besoin d'agents coiffants supplémentaires. Simplement en faisant varier le temps entre l'addition de HAuCl4 à une solution alcaline et l'addition subséquente de l'agent réducteur, thiocyanate de sodium, nous sommes en mesure de faire varier la taille résultante des particules d'or de
25 nm. Pour produire des particules plus grandes, une procédure simple add-on peut être utilisé pour cultiver ces oligoclusters par l'ajout d'or hydroxylés (HG) aux oligoclusters comme synthétisés en présence de thiocyanate de sodium. L'utilisation de ces deux méthodes, nous sommes en mesure de produire de manière fiable oligoclusters couvrant une plage de
70 nm. Le fait que cette méthode permet la synthèse bien contrôlée de oligoclusters d'or de haute qualité dans des conditions de paillasse avec des équipements standard et un nombre limité de réactifs étend potentiellement les avantages de nanoparticules d'or comme un outil de recherche pour les chercheurs peu ou pas d'expertise dans la synthèse chimique.
1. Préparation des réactifs
Préparation du chlorure d'orDissoudre 1 g de trihydrate de chlorure d'or (III) dans 100 g d'H2 O pour donner 25 mM de HAuCl4.
Dissoudre 3,81 g de borax dans 100 g de H2 O pour donner 0,1 molale borax (chaud si nécessaire pour assurer une solution complète).
Préparation du thiocyanate de sodiumDissoudre 8,1 g de thiocyanate de sodium dans 100 g d'H2 O pour donner une molal NaSCN.
Préparation de carbonate de sodiumDissoudre 5,3 g de carbonate de sodium anhydre dans 100 g d'H2 O pour donner 0,5 molale Na2 CO3.
Préparation du glutathionDissoudre 154 mg de glutathion réduit (GSH) par 1 ml de 0,5 molale Na2 CO3 pour donner 0,5 molale GSH.
2. Synthèse de l'or Oligoclusters
Retard temps Synthèse de l'or OligoclustersAjouter 59,5 ml de H2 O à une bouteille en verre Wheaton propre 125 ml contenant un barreau d'agitation. Utilisez un récipient en verre propre à fond plat, mais assurez-vous qu'il est très propre.
Ajouter 7 ml de 0,1 borax molal et apporter une solution à une agitation vigoureuse.
25 mM HAuCl4 sous agitation vigoureuse et le temps d'attente de retard désiré (addition de HAuCl4 commence le temps de retard). Les décalages détermineront la taille des oligoclusters comme synthétisés comme indiqué dans le tableau 1.
Après un temps de retard souhaité, ajouter 700 # X000b5; l d'une NaSCN molal sous agitation vigoureuse brève (1200 tours par minute pendant 30 secondes).
Retirer le barreau d'agitation et laisser la réaction aller à son terme O / N (distribution de la taille des oligoclusters peut encore être améliorée en permettant à mélange en remuant sans cesse O / N alors que la réaction va jusqu'à l'achèvement). Une fois que la réaction est arrivé à l'achèvement des oligoclusters bruts tels que synthétisés sont stables pendant plusieurs semaines.
Add-on de la croissance OligoclustersMoissonneuse 10 ml de oligoclusters telles que synthétisées à 60 ml de HG. Le rapport de oligoclusters telles que synthétisées à HG détermine la taille de oligoclusters résultant, en augmentant la quantité relative de HG produit oligoclusters plus grandes.
Ajouter 900 # X000b5; l d'une NaSCN molal sous agitation vigoureuse brève (1200 tours par minute pendant 30 secondes).
Laisser la réaction aller à son terme O / N (distribution de la taille des oligoclusters peut encore être améliorée en permettant à mélange en remuant sans cesse O / N alors que la réaction va jusqu'à l'achèvement).
3. GSH dérivatisation et la concentration de Oligoclusters
Ajouter 70 ml de oligoclusters brutes telles que synthétisées (ou oligoclusters de la méthode add-on) dans un filtre centrifuge de coupure 70 ml 30 kDa.
Spin pendant 15 min à 3000 x g. Ceci concentre les particules à un volume de
Dispositif retourner et à récupérer le rétentat par le dispositif de filage pendant 3 min à 500 x g. le volume récupéré doit être
Mesure récupéré volume à l'aide d'une micropipette.
Ajouter un volume de 0,5 glutathion molal (ou un autre thiol) égal à 1/9 ème le volume récupéré de oligoclusters concentré (concentration finale 50 mmolal GSH).
Ajouter tous les dérivés oligoclusters dilué à 30 kDa coupure filtre centrifuge.
Faites tourner le filtre centrifuge pendant 15 min à 3000 x g.
Dispositif retourner et à récupérer le rétentat par le dispositif de filage pendant 3 min à 500 x g. le volume récupéré doit être
250 # X000b5; l. Les particules récupérées sont concentrées et prêtes à l'emploi sont stables pendant des mois à 4 # X000b0; C.
4. Analyse et vérification des Oligocluster Synthèse
L'électrophorèse sur gel de OligoclustersMélanger les préparations de oligocluster telles que synthétisées 2: 1 avec du tampon de charge contenant 60% de glycerol,
0,15% de bleu de bromophénol et 150 mmolal GSH (stock de 0,5 molale GSH dissous dans 0,5 molale Na2 CO3).
charge 30 # X000b5; l sur gel précoulé de gradient de polyacrylamide (tout kDa) et de fonctionner avec du Tris-Glycine tampon courant (25 mM de Tris, 192 mM de glycine; pas de SDS est utilisé) pour 26 min à tension constante (200 V).
Electrophorèse de GSH Oligoclusters en dérivésDiluer GSH-dérivatisé oligocluster préparation 1: 3 avec H2 O (2 Typiquement # X000b5; l de BA-oligoclusters avec 6 # X000b5; l H2 O).
Mélange dilué GSH-dérivatisés oligoclusters 2: 1 avec du tampon de charge contenant 60% de glycerol,
0,15% de bleu de bromophénol et 150 bicarbonate de sodium mmolal.
charge 10 # X000b5; l sur gel précoulé de gradient de polyacrylamide (tout kDa) et de fonctionner avec du Tris-Glycine tampon courant (25 mM de Tris, 192 mM de glycine; pas de SDS est utilisé) pour 26 min à tension constante (200 V).
# X000a0; microscopie électronique à transmission (MET)Pour laver oligoclusters dilué 20 # X000b5; l de oligoclusters concentré avec 0,5 ml de H2 O et la charge dans un filtre centrifuge de coupure 0,5 ml 30 kDa.
Centrifuger à 14 000 x g pendant 10 min.
Retirer le filtrat et rétentat de remettre en suspension avec un nouveau 0,5 ml de H2 O.
Répétez le lavage deux fois pour un total de 3 lavages.
Diluez rétentat final 500 fois dans H2 O (oligoclusters sont prêts pour mailler à ce stade).
décharge luminescente grille revêtue de carbone.
Caution 0,6 # X000b5; l de oligoclusters lavées et diluées sur une grille déchargée luminescente revêtue de carbone.
Laisser grille sécher à l'air pendant 10 min.
Visualisez oligoclusters par MET à 100,000X grossissement. Faire fonctionner à 80 kV pour les images présentées ici.
Les résultats représentatifs
Les synthèses des oligoclusters d'or ont été analysés par électrophorèse sur gel (figure 1) et microscopie électronique à transmission (TEM) (figure 2). La taille de oligoclusters revêtues GSH peut être contrôlée par électrophorèse des particules plus grosses migrent moins et apparaissent plus sombres. De plus, la qualité d'une préparation de taille donnée peut être déduite par la largeur de la bande observée après électrophorèse (par exemple, pour une taille donnée, les préparations avec des distributions de taille plus étroits vont produire un resserrement des bandes que les préparations de la même taille avec des distributions de taille plus larges) . La figure 2 décrit la relation de temporisation (méthode temps de retard) ou HG: graines (méthode add-on) à oligocluster taille. des diamètres moyens calculés par MET sont utilisées pour déterminer le temps de retard, et HG: la croissance de la dépendance à l'égard de la graine de oligoclusters de temps de retard et méthodes add-on, respectivement. Un organigramme (figure 3) présentant la procédure pour les deux méthodes et un tableau (Tableau 1) fournissant des paramètres prédits pour produire oligoclusters de la taille désirée sont présentés.
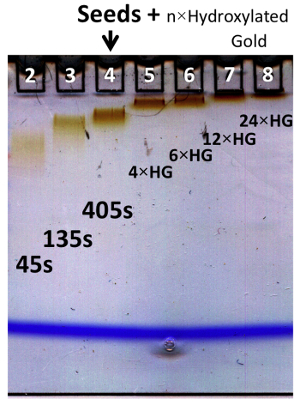
Figure 1.Polyacrylamide électrophorèse sur gel à gradient de oligoclusters formés par le temps de retard et les méthodes Add-on. Oligoclusters produits par temps de retard et les méthodes add-on ont été analysés par électrophorèse sur gel à gradient. Les pistes 2-4: oligoclusters formés après différents temps de retard (45, 135, et 405 sec) entre la prise de HAuCl4 alcalin et l'addition de NaSCN. Lanes 5-8: oligoclusters formés par la méthode add-on. Les graines ont été formées par le procédé de temps de retard avec 405 sec # x000a0, le retard, indiqué par # X02193 ;. Des quantités variables de HG ont été utilisés pour add-on. Les rapports de solution HG (1 mM en or) à la solution de germe (1 mM dans de l'or) utilisé pour la préparation de chaque échantillon sont indiqués, comme 4xHG, 6xHG, 12xHG et 24xHG. S'il vous plaît cliquer ici pour télécharger ce fichier.
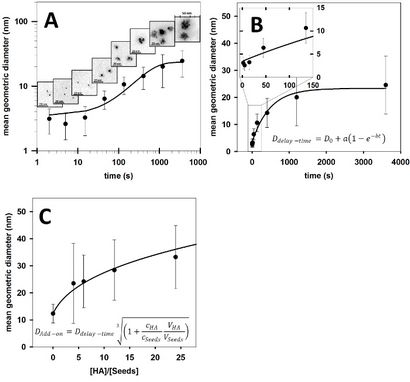
3,5 nm); a est l'augmentation maximale de la taille de l'âme causée par l'extension du temps de retard (
20 nm), et b = 0,0021 s -1. (B) Diamètres des oligoclusters formés après différents temps de retard avant l'addition de NaSCN (méthode temps de retard) qui figure sur une échelle linéaire. (C) Diamètres des oligoclusters formés après addition (méthode add-on) de différentes quantités de HG sur les graines d'or préformées formées par la méthode de temps de retard avec 405 sec # x000a0, le temps de retard. Comme le montre la ligne noire, il peut être facilement vu que le diamètre de oligoclusters formé par la méthode add-on est
où CHG et cSeeds sont les concentrations d'acide chloroaurique utilisés dans la fabrication de la solution de HG de méthode add-on et à faire oligoclusters par le procédé de temps de retard, respectivement. De même VHG et VSeeds sont les volumes correspondants. S'il vous plaît cliquer ici pour télécharger ce fichier.
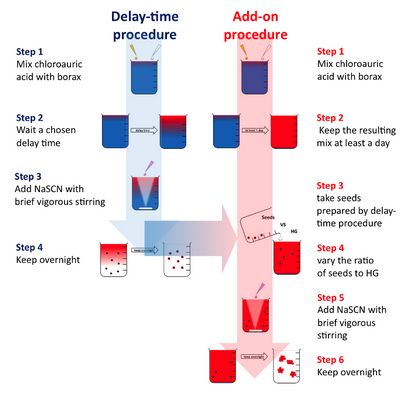
Figure 3.Wall diagramme de diagramme de retard-temps et les méthodes Add-on pour faire oligoclusters d'or de différentes tailles. Organigramme décrivant les procédures de synthèse oligoclusters d'or de différentes tailles en utilisant soit le délai temps ou les méthodes add-on. La solution alcaline de l'acide chloroaurique est bleu. Le HG est rouge. Les graines de nanoparticules d'or et oligoclusters sont noirs. S'il vous plaît cliquer ici pour télécharger ce fichier.
où CHG et cSeeds sont les concentrations d'acide chloroaurique utilisés dans la fabrication de la solution de HG de méthode add-on et à faire oligoclusters par le procédé de temps de retard, respectivement. De même VHG et VSeeds sont les volumes correspondants.
Discussion
La méthode add-on a deux limites, dont la première est le grand volume de réaction nécessaires à haute HG: ratios de semences. Une deuxième limite à la méthode add-on provient du fait que mentionné ci-dessus hydroxylation de HAuCl4 est une réaction d'équilibre et ne va pas à son terme. La hydroxylation incomplète de HAuCl4 a une influence minime sur la réaction d'add-on lorsque la concentration des graines de oligocluster reste élevé. Lorsque la concentration des graines de oligocluster sont faibles, comme cela est le cas lors de l'utilisation de semences à long temps de retard et de haute HG: rapports de semences, l'influence des non hydroxylé HAuCl4 peut devenir importante. Dans ces conditions HAuCl4 est en mesure de nucléée la synthèse de nouveaux oligoclusters, ce qui entraîne des populations hétérogènes de oligoclusters.
Les oligoclusters bruts de synthèse produits par retard de temps ou méthode add-on sont stables pendant des semaines, le développement que des quantités de traces de précipité d'or. Même après avoir été concentré 300 fois les oligoclusters restent stables et résistent agrégation. Les oligoclusters d'or décrits ici ont également l'avantage de pouvoir se concentrer sans dérivatisation préalable, permettant ainsi des agents coûteux de dérivatisation à utiliser dans des volumes plus petits. Après avoir été dérivé avec le glutathion (GSH), les clusters sont restés stables jusqu'à un an. GSH-dérivatisation fournit également une forte charge négative 13 qui les fait résister à l'agrégation lorsqu'elle est exposée à des tampons physiologiques ou plasma animal, ce qui les rend appropriés pour des expériences in vivo. Dérivatisation peut être réalisé avec une grande variété de groupes thiol contenant des réactifs.
Le amenability des oligoclusters à dérivatisation avec d'autres molécules contenant du thiol 17,18 permet de modifier pratique et facile de la monocouche de surface, chimie de surface contrôlant ainsi la réactivité et de oligoclusters. D'autres produits chimiques utilisés dans ce protocole peuvent être facilement remplacés par des produits chimiques similaires, sans altérer la synthèse. Cela comprend le remplacement de borax avec d'autres tampons alcalins (par exemple de carbonate) et le thiocyanate de sodium pour les autres sels de thiocyanate, par exemple KSCN ().
L'attribut principal de ce protocole est sa simplicité, qui doit être souligné. Seule une échelle de poids milligramme et agitateur magnétique est nécessaire pour produire oligoclusters d'or de qualité commerciale qui peuvent être utilisés pour des applications biologiques et matériaux avancés. application à grande échelle est facilitée par le large éventail de tailles que peut être produit et par monodispersité. De plus, la production maison est faible coût.
Les oligoclusters sont particulièrement utiles pour les études de perméabilité des membranes basales et les barrières du sang. Ils peuvent être facilement administrés avec une solution saline à travers des voies différentes et suivis in vivo 19-21. Des échantillons de tissus obtenus peuvent être ensuite examinées au microscope électronique 16,22. En plus de la perméabilité, la distribution bio fournit des informations précieuses pharmacologique et l'administration du mélange de oligoclusters de tailles différentes donne des informations précieuses sur la taille de distribution en fonction des particules à l'intérieur du corps 23-25. Enfin, en raison de leur structure unique, ils ne parviennent pas à manifester une résonance plasmonique de surface localisée (LSPR) peut-être ce qui les rend des candidats idéaux pour un marquage fluorescent, ce qui est facilement réalisable dans des nanoparticules d'or en raison des interférences entre les résultats de LSPR et fluorophores dans une trempe presque complète de la fluorescence 26 .
informations à fournir
Les auteurs n'ont rien à dévoiler.
Remerciements
# X000a0 T.K., reconnaît # x000a0, le soutien # x000a0, de la # x000a0, Agence de recherche Slovénie (ARRS, accorde BI-US / 13-14-040 et J3-6803). Pouvant être élué # reconnaît x000a0, le soutien # x000a0, de l'Institut national de la santé (NIH) subvention RO1HL49277.
Les références
Articles de Journal d'expériences. Visualisées JoVE sont fournis ici avec la permission de MyJoVE Corporation