Analyse conformationnelle Cyclohexane
Energies et conformations Cyclohexane
TABLE DES MATIÈRES POUR CE CHAPITRE
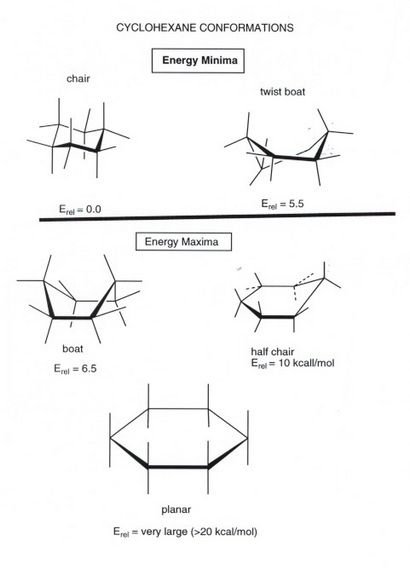
- Le plus simple conformation imaginables pour le cyclohexane, l'une plane, est non seulement pas la conformation de l'état fondamental, il est donc riche en énergie qu'il ne joue aucun rôle dans l'analyse conformationnelle de .Cet cyclohexane est principalement en raison de la grande quantité de contrainte de torsion qui est présent sous cette forme. Ainsi, l'ensemble des six liaisons C-C dans la forme plane sont éclipsées, de sorte que l'on pourrait grossièrement estimer la contrainte de torsion comme étant d'au moins 6 fois supérieure à celle de l'éthane éclipsée, qui a une éclipse liaison C-C, ou 18 kcal / mole.
- La conformation de l'état fondamental de cyclohexane est une conformation totalement décalée qui est en forme un peu comme une « chaise ». Dans cette configuration, il n'y a pas de contrainte de torsion du tout, et comme nous le verrons plus loin, aucune contrainte d'aucune sorte. Cyclohexane est unique en étant le seul hydrocarbure cyclique qui est complètement exempt de contrainte. Ainsi, le cycle à six chaînons est le plus stable de all.So, nous voyons que les effets de torsion, bien que petite individuellement (par liaison C-C), exercent un effet extrêmement important sur les formes des molécules et des formes affectent souvent la réactivité.
- Dans la conformation chaise, quatre atomes de carbone sont coplanaires, et les deux autres sont plissées sur ce plan, l'une étant plissée au-dessus de ce plan (le carbone à l'extrême droite de la forme de la chaise représentée) et une étant plissée vers le bas hors de ce plan (l'une à l'extrême gauche de l'illustration). Une autre conformation qui est important dans toute analyse conformationnelle est l'état de transition, ou la conformation d'énergie maximale sur le cyclohexane path.For de rotation tel est le soi-disant « conformation demi-chaise », dans laquelle maintenant 5 atomes de carbone sont co-planaires, et que une est froncé en dehors du plan. Dans l'illustration ci-dessus, à partir de la conformation chaise, la forme demi-chaise représenté vient de déplacer la main gauche plus de carbone de la forme de chaise. qui est plissée vers le bas, vers le haut dans le plan des quatre atomes coplanaires. Cela crée l'effort de torsion considérable, en particulier autour des deux liaisons carbone-carbone impliquant la gauche plus de carbone. L'énergie de cette conformation est d'environ 10 kcal / mol. L'importance est que dans tous les changements conformationnels dans le cyclohexane, 10 kcal est la barrière d'énergie, et la voie de ces changements conformationnels doit passer par cette conformation.Because d'énergie relativement élevée cette barrière est tellement plus grande que celle de l'éthane ou le butane, changements conformationnels cyclohexane peuvent être « gelés sur » à, par exemple, -78 degrés. Cependant, ils sont rapides à ou près de la température ambiante. À toutes fins pratiques, seule la forme de chaise est rempli.
- Il y a, comme dans le cas du butane, une autre structure minimale d'énergie qui peut être générée dans une certaine mesure. Ceci est la soi-disant conformation « bateau de torsion ». Cependant, étant donné que cette conformation est de 5,5 kcal / mol plus élevée en énergie que la conformation de la chaise, il est un state.Again très peuplée, la plupart des résultats de l'énergie de déformation des liaisons qui sont éclipsées ou partiellement éclipsé, à savoir de contrainte de torsion.
CYCLOHEXANE CONFORMATIONNELLE SCHÉMA DE L'ÉNERGIE
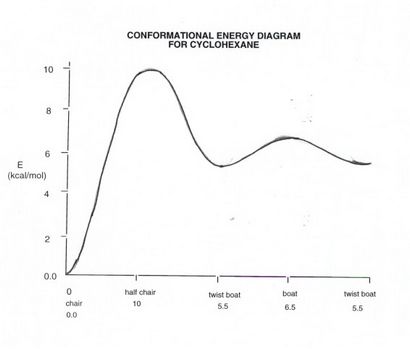
- A noter que dans le cyclohexane de la chaise, il existe deux types différents de liaisons C-H, et donc deux types d'atomes d'hydrogène chimiquement différents. Les liaisons C-H qui pointent vers le haut ou vers le bas verticalement sont appelés axial. Il y a 6 d'entre eux, 3 vers le haut et 3 liaisons vers le bas, et ils alternent haut / bas / haut, etc. autour de l'anneau. Les six autres liaisons, qui rayonnent loin de la « équateur » de la bague sont appelés équatoriale, et de nouveau il y a six, dont 3 sont « biais » et 3 de whicdh sont « incliner vers le bas », en alternant à nouveau autour de l'anneau.
Vous devriez être en mesure de tirer rapidement des anneaux cyclohexane dans lesquels les liaisons axiales et équatoriales sont facilement identifiables et reconnaissables.
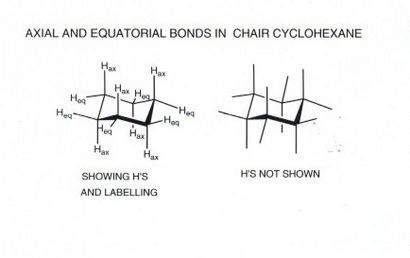
CHAISE / FAUTEUIL interconversion OU FLIP RING
- Jusqu'à présent, nous n'avons pas décrit en détail le chemin de rotation de cyclohexane et ce qui est le résultat final. Nous comprenons que le meilleur chemin (le chemin d'énergie la plus basse) de produit disponible via la chaise de moitié et nécessite un apport d'énergie de 10 kcal / mol. Cet état de transition procède à un minimum d'énergie de bateau de torsion, mais ce n'est pas très popupulated et joue généralement peu ou pas de rôle dans la structure de cyclohexane ou de la chimie. Cependant, le bateau de torsion peut interconvertir avec un autre bateau de torsion équivalente (via la vraie conformation en bateau comme un état de transition) pour donner une autre structure de chaise, dans laquelle le sens de l'anneau plissement est inversé. Ceci est important dans le cyclohexane lui-même, parce que dans ce procédé la direction axiale et hydrogènes équatoriaux sont interconverted.Since cette interconversion ou flip anneau occrus rapidement à la température ambiante, tous les atomes d'hydrogène passent 50% de leur temps comme hydrogènes axiaux et 50% de leur temps comme équatorial hydrogènes, de sorte que la moyenne de temps toutes les liaisons CH de cyclohexane sont équivalentes. Cependant, à un instant donné, il y a toujours deux types d'hydrogène.
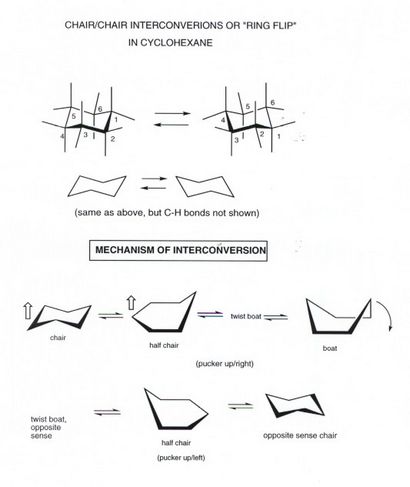
méthylcyclohexane CONFORMATIONS
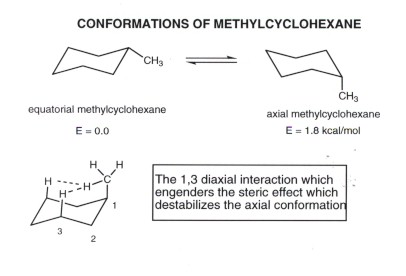
- Etant donné que des liaisons axiales et équatoriales ne sont pas équivalentes, il existe deux positions non équivalentes dans lequel placer un substituant quelconque. Nous utilisons le groupe méthyle simple, à titre d'exemple, mais le même concept applique à tout substituant.
- le méthyl cyclohexane équatorial est la conformation plus stable. Lorsque le clapet annulaire se produit, cependant, il se transforme en axiales méthylcyclohexane. Ces deux conformations sont en équilibre rapide à la température ambiante, mais peuvent être congelés en composés distincts à -78degrees.
- Le conofrmation équatorial est favorisée dans l'équilibre d'une quantité modeste, car l'isomère axial a environ 1,8 kcal / mol de la souche stérique. Cette souche provient de l'interaction de l'un des atomes d'hydrogène du groupe méthyle axial avec chacun des deux autres atomes d'hydrogène axiales sur le même côté de l'anneau, comme illustré ci-dessus. Chacun de ces interacgions stérique est approximativement équivalente à une interaction de butane gauche de 0,9 kcal / mole, de sorte que le total est de 1,8 kcal / mol. Le point de la comparaison de butane gauche est que la distance H / H des atomes d'hydrogène est presque exactement la même dans butane gauche à empêchement stérique comme avec du cyclohexane de méthyle axial, à l'exception qu'il y a deux telles interactions H / H dans ce dernier cas.
- Les interactions stériques dans le méthylcyclohexane axial sont appelés « interactions 1,3-diaxiales », parce que les interactions comportent deux atomes ou groupes axiaux (un H et CH3 et l'un des atomes de carbone portant ces atomes ou groupes sont liés à 1,3.
- LE « PRINCIPE EQUATORIALITY » PREVOIT QUE SUBSTITUANT PREFERE TOUT LE MOINS OCCUPER POSITION stériquement encombrées EQUATORIALE, SI POSSIBLE.IN À TOUS LES CAS DE DI- OU cyclohexanes de polysubstitué PAS TOUS LES SUBSTITUTS PEUT OCCUPER POSITIONS DANS CHAQUE EQUATORIAL ISOMÈRE, MAIS QUE ISOMÈRE SERA LE PLUS STABLE DANS LEQUEL TOUS LES SUBSTITUTS occuper POSITIONS EQUATORIAL (voir exemples ci-dessous).
disubstitué cyclohexanes
1,4-diméthylcyclohexane
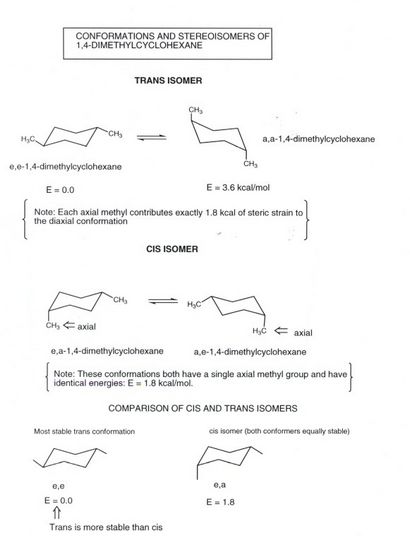
- Notez que le motif 1,4-disubstitution, l'arrangement diequatorial (mosts stable) est ce que nous appelons l'isomère « trans ». en elle, un substituant est « oblique » et une « inclinaison vers le bas ». le retournement de l'anneau donne une conformation dans laquelle les substituants méthyle sont anti (angle dièdre de 180) à l'autre, mais cela est encore trans. et thisconformation est moins stable car il a deux substituants axiaux.
- Il y a un autre isomère de 1,4-diméthylcyclohexane, l'isomère cis. Rappelons que les isomères cis et trans sont diastéréoisomères, ils ne sont pas différentes conformations de la même isomère et ne peuvent pas être facilement interconversion par un procédé simple de rotation (une liaison devrait être rompu) .Dans l'isomère cis, ici, un groupe méthyle est équatorial et un axial, et l'anneau retournement donne simplement une autre conformation équivalente. Etant donné qu'un méthyle est axial, cela coûte 1,8 kcal de la souche stérique. Par conséquent, l'isomère cis est moins stable que le thermodynamiquement trans, qui n'a pas de contrainte stérique dans la conformation plus stable. La différence d'énergie est à nouveau, 1,8 kcal / mol.
- Dans l'isomère cis, un substituant est verticalement vers le haut (ou vers le bas) et l'autre oblique vers le haut (ou vers le bas). Donc, ils ont tous deux points, dans un sens général, dans le même sens, à savoir à la fois vers le haut ou vers le bas à la fois.
1,3-diméthylcyclohexane

- Dans le motif 1,3-disubstitution (si elle est diméthyle ou tout autre 1,3-dibsubstitution), les deux groupes ne peuvent être équatorial quand ils sont à la fois cis. Ainsi, l'isomère cis est l'isomère plus stable dans ce cas. flipping Ring donne une conformation de l'isomère cis qui a les deux méthyles axiaux. Pire, ils sont tous deux sur le même côté de l'anneau, de sorte qu'il ne constitue pas un méthyle axial / axial interaction d'hydrogène plus longtemps, il est un méthyl axial / axial interaction de méthyle, qui est stériquement bien pire. Par conséquent, ce flip anneau est trop difficile énergétiquement, et ce conformateur peut être négligé dans l'analyse, il conformationnelle.
- L'isomère trans-1,3-diméthylcyclohexane. d'autre part, a une axial de méthyle dans les deux conformères anneau bascules, de sorte qu'il est moins stable que l'isomère cis de 1,8 kcal / mol.
- Les deux trans-1,4-diméthylcyclohexane et le cis-1,3-diméthylcyclohexane ont essentiellement la même énergie, puisque ni l'un d'eux a une souche du tout.

Le motif 1,2-disubstitution est très semblable à la configuration 1,4, en ce que les deux groupes ne peuvent être equatorial si elles sont trans, de sorte que l'isomère trans est plus stable que l'isomère cis. Le diaxiale trans conformère a 3,6 kcal de la souche stérique, bien sûr et beaucoup moins favorisés que le conformère diequatorial.
L'isomère cis est moins stable que le trans car en elle, un méthyle doit être axial. L'isomère cis est donc moins stable que la trans de 1,8 kcal.
La principale différence entre les 1,2 et 1,4 motifs, est que, dans la conformation 1,2 diequatorial, les groupes méthyle sont dans la gauche comme le butane gauche (rappelons que gauche implique essentiellement un angle dièdre de 60 degrés). Par conséquent, cette conformation diequatorial n'est la souche libre, comme cela a été la conformation 1,4-trans diequatorial, où les méthyles sont très éloignés. L'isomère 1,2-diequatorial est de 0,9 kcal / mol moins stable que l'isomère 1,4-diequatorial, en raison de cette interaction gauche de butane-like (rappelons que l'isomère gauche en butane est déstabilisée par exactement cette quantité).