Chimie de l'eau
- D'autres ont trouvé dans l'eau comme l'état de trace sont H2. CO, NO2 (protoxyde d'azote), O3 (ozone), CH4 (méthane), NH3 (ammoniac), SO2 (dioxyde de soufre), le krypton et le néon.
L'oxygène (oxygène dissous, DO)
· De ce fait, à 4 ° C, l'eau est saturé (100%) avec de l'oxygène, de maintien 10,92 mg / l.
o Nota bene. saturation de 100% ne signifie pas que plus d'O2 peut être maintenu en solution. J'ai mesuré DO> 200%. Est-ce que cela signifie que les bulles doivent être se former? Pas nécessairement. La saturation ici signifie que 10,92 mg / l peut être maintenu en équilibre; si 200% est produit par l'activité photosynthétique intense, le montant supplémentaire sera perdue (diffusée) à l'interface air / eau.
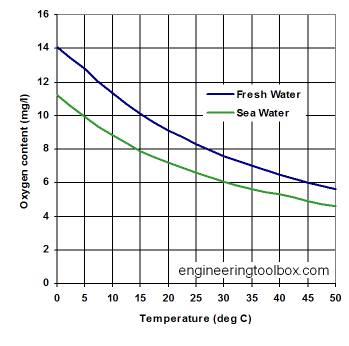
Solubilité de l'oxygène dans l'eau à 760 mm Hg de pression
· I s effectue par altitude (pression d'air); à des altitudes plus élevées, il y a moins de pression d'air et moins O2. La saturation est généralement compris pour la pression du niveau de la mer (760 mm = 1 ATM). Quelle est notre altitude?
· P ression exerce un rôle aussi; rappeler que les augmentations de pression 1 ATM / 10 m; en profondeur il y a beaucoup plus de pression sur les gaz à rester en solution. Par conséquent, il est difficile pour les bulles pour former contre elle. Par conséquent, il faut des taux très élevés de sursaturation (par rapport à la pression de surface) pour provoquer la formation de bulles. (Penser d'une bouteille scellée contre ouverte de la bière).
un nomogramme peut être utilisé pour déterminer le degré de saturation; utiliser une règle pour relier la température de l'eau et à faire. Lire la saturation% à l'intersection de cette ligne avec la ligne médiane.
Oxygène dissous% saturation Nomogramme
o Comment l'eau peut être sursaturé?
§ affecte les poissons si elles sont soumises pendant quelques heures à> 115% de saturation; des bulles se forment dans les tissus; embolies recueillir dans les branchies causant anoxie et la mort; affecte également cladocères. Autres biote, par exemple écrevisses et stoneflies sont plus résistantes.
· E ffet de la salinité.
o ceanic moyennes de salinité
o t la même température, eau de mer contient environ 20% de moins de O2 lorsqu'il est saturé; par exemple. à 0 ° C eau douce est saturée à 14,2 mg / l, alors que l'eau salée est saturée à 12,0 mg / l.
Les sources de gains / pertes d'eau O2
- dissolution à l'interface air / eau
- un processus très lent, prendrait des années pour tout pour atteindre 5 m;
- turbulence porte O2 de la surface à la profondeur; comment dépend beaucoup de la façon dont une grande partie du lac est en circulation; ondes entraîné par le vent et les courants sont critiques.
- Note: l'agitation et la turbulence sont une source de perte de O2 si les eaux sont sursaturées.
- photosynthèse: 6 CO2 + H2 O 6 ® C6 H12 O6 + 6O2
- apport d'oxygène de l'eau riche
- identique à (1) ci-dessus
- la respiration par les plantes, les animaux, les microbes
4. l'augmentation des températures.
Profil orthograde. La ligne pointillée représente la température; ligne pleine est D.O.
profil Clinograde. La ligne pointillée représente la température; ligne pleine est D.O
- La plupart des pertes O2 est à l'interface eau / sédiment
- l'utilisation de la respiration de O2 se produit dans toute la colonne d'eau; il est le plus élevé où la plupart des organismes sont, dans la zone photique. Il, cependant, la production O2 est bien au-delà de l'utilisation.
- d'où vient la production O2 = utilisation de O2. Le point de compensation où
- Rappelons que O2 peut être utilisé dans des réactions non-biologiques, chimiques strictement, la demande chimique en oxygène (DCO).
Les écarts par rapport à ces profils:
Les courbes de Heterograde (hétéro = différent)
- provoquée par une forte concentration / faible de DO dans des endroits apparemment improbable
- par exemple. heterograde positif. causé par un maximum métalimnétique O2 -généralement en raison d'une forte concentration de photosynthétiques à métalimnion. Pourquoi là-bas? Espèces adaptées à faible luminosité et à basse température font usage de plusieurs éléments nutritifs dans le métalimnion par rapport à l'épilimnion, par exemple, le cyanophyte, Oscillatoria.
Profil positif Heterograde. La ligne pointillée représente la température; ligne pleine est D.O
Profil négatif Heterograde. La ligne pointillée représente la température; ligne pleine est D.O
River Profil longitudinal
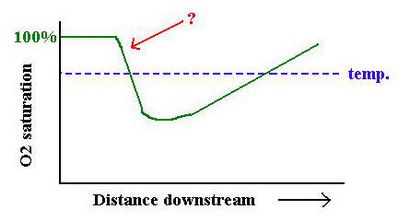
Ce qui a causé ce profil d'oxygène?
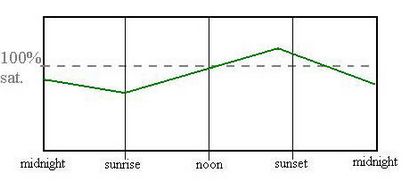
cycle de Diel d'oxygène épilimnétique contenu comment la teneur en oxygène varie au cours d'une journée?
Mesure de la DO
Deux méthodes dominantes sont aujourd'hui
- Compteur d'oxygène / sonde
- Méthode de Winkler de titrage O2.
· O2 traverse une membrane, crée un flux de courant à travers les électrodes; plus O2. plus courant
· Mètres de type aiguille sont r ead directement pour éviter les erreurs de parallaxe à l'aide d'un miroir
· Nécessite une agitation que l'oxygène est épuisée au niveau des électrodes, donc sinon agité, DO niveau va progressivement baisser.
· Doit être régulièrement calibré
· Confiance que les machines si elles sont dignes de confiance!
Winkler titrage d'un test de laboratoire (chimie du banc) qui est la base pour les tests de kit Hach.
- prélever des échantillons d'eau distincts de différentes profondeurs avec des bouteilles Kemmerer ou Van Dorn.
- transférer et surchargez bouteilles de DBO sans turbulence;
- chimie Winkler
§ sulfate manganeux (réactif 1) réagit avec l'hydroxyde de potassium iodure de potassium (iodure alcalin - réactif 2) pour produire un précipité floconneux blanc d'hydroxyde manganeux:
- en cas de DO dans l'eau une deuxième réaction entre le Mn (OH) 2 et ne se produit immédiatement pour former un floc d'oxyde manganique brunâtre:
- une autre réaction avec de l'iodure de potassium libère une quantité d'iode équivalent à l'oxygène d'origine.
précision comment reproductibles sont vos résultats? auriez-vous la même réponse si vous Titré à nouveau; Quelqu'un d'autre obtenir la même réponse en utilisant votre échantillon?
souvent exprimée en concentration équivalente CaCO3.
dureté = ____ mg / l en CaCO3
brisé en dureté temporaire et permanent.dureté permanente est la partie qui reste en solution à l'ébullition.