conformation Cyclohexane - The Full Wiki
Une molécule de cyclohexane en conformation chaise. Les atomes d'hydrogène en positions axiales apparaissent en rouge, tandis que ceux dans des positions équatoriales sont en bleu.
Contexte historique
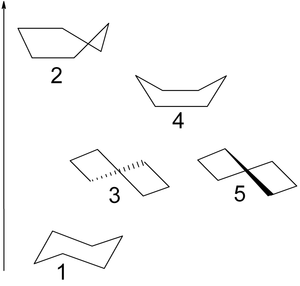
conformation chaise
En raison de la tendance inhérente des orbitales hybrides SP³ (et donc les liaisons carbone-hydrogène) sur les atomes de carbone tétravalent pour former des angles de liaison de 109,5 °, le cyclohexane ne forme pas une disposition hexagonale plane avec des angles de liaison intérieurs de 120 °. La conformation chaise est un terme utilisé pour la conformation chimique le plus stable d'un cycle à six chaînons unique de carbone lié comme le cyclohexane. Derek Barton et Odd Hassel à la fois partagé le prix Nobel pour le travail sur les conformations de cyclohexane et d'autres molécules.
Dans la conformation chaise d'énergie le plus bas, 6 des 12 atomes d'hydrogène sont dans des positions axiales (de couleur rouge) -Leurs liaisons CH sont parallèles entre eux et semblent à coller haut et en bas de la structure cyclique, les 6 autres sont dans des positions équatoriales ( de couleur bleue) -Ils sont évasé autour du périmètre de l'anneau. A noter que, en plus, un hydrogène à chaque position est « haut » par rapport à l'autre étant « bas » à cette position.
La préférence d'un substituant vers la conformation équatoriale est mesurée en termes de sa valeur de A. qui est la différence d'énergie libre de Gibbs entre la zone équatoriale et les conformères axiaux. Une valeur positive indique une préférence pour la position équatoriale. L'amplitude des valeurs de A est comprise entre presque zéro pour les substituants très petits tels que le deuterium. à environ 5 kcal / mol pour les substituants très volumineux tels que le groupe tert-butyle.
conformation bateau
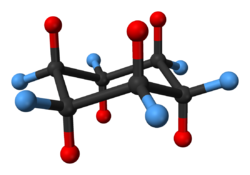
En plus de la conformation de la chaise (1) avec du cyclohexane de symétrie D3d peuvent également exister dans le demi-chaise ou de l'enveloppe (2), la torsion ou torsion bateau (3,5) à symétrie de D2 et de bateau (4) conformères. Seule la forme de torsion est isolable comme - comme la forme de chaise - il représente un minimum d'énergie. La conformation du bateau ne souffre pas de la souche d'angle, mais a une énergie plus élevée que la forme de la chaise en raison de la souche stérique résultant des deux atomes axiaux 1,4-hydrogène, dans ce qu'on appelle l'interaction de mât. La contrainte de torsion dans la conformation en bateau a une valeur maximale, car deux des liaisons carbone sont éclipsés. Comparer cela à la chaise avec tous les liens décalés et l'absence totale de contrainte de torsion et la torsion Bateau avec 4 sur 6 liaisons partiellement éclipsé. Dans la conformation demi-chaise 4 atomes de carbone sont situés sur un plan dans lequel deux liaisons sont totalement éclipsé.
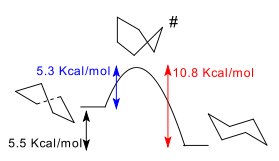
Les formes de bateau et l'enveloppe sont des états de transition entre les formes de torsion et la torsion et les formes de chaise respectivement, et sont impossibles à isoler. La conformation de torsion bateau est de 5,5 kcal / mol (23 kJ / mol) moins stable que la conformation chaise. Les énergies des deux états de transition sont de 6,6 kcal / mol (28 kJ / mol) (bateau) et 10,8 kcal / mol (45 kJ / mol) (chaise moitié) supérieure à celle de la chaise. [4] Le processus de retournement de l'anneau peut maintenant être décrite avec plus de précision comme ayant lieu à travers une conformation torsion bateau et au moyen de deux états de transition de demi-chaise.
La différence d'énergie entre la chaise et la conformation de torsion bateau de cyclohexane peut être mesurée indirectement en prenant la différence d'énergie d'activation pour la conversion de la chaise à la conformation torsion bateau et celle de l'isomérisation inverse. La concentration de la conformation torsion bateau à la température ambiante est très faible (inférieure à 0,1%), mais à 1073 kelvins cette concentration peut atteindre 30%. La réaction inverse est mesurée par spectroscopie IR après le refroidissement rapide de cyclohexane à partir de 1073 K à 40 K, le gel dans la grande concentration de conformation torsion bateau.
[6,6] Chiralane [5] [6] est une molécule de T de groupe de points entièrement composé de cyclohexanes twist-boat condensés identiques. Twistane est un autre composé avec une conformation torsion bateau forcé.
dérivés de cyclohexane
Le cyclohexane Substituants trouvés adoptent cis et trans formations et ne peuvent pas être facilement commutées par simple rotation simple de liaison sigma avec des molécules linéaires. formation Cis signifie que les deux substituants se trouvent sur le côté supérieur des 2 emplacements de substituant sur le carbone, alors que trans signifierait qu'ils sont sur des côtés opposés. Malgré le fait que sur les carbones cyclohexane sont liés par une liaison simple, l'anneau reste rigide, en ce que la commutation de cis à trans, il faudrait casser l'anneau. La nomenclature des cis est doublé (Z), tandis que le nom de trans est (E) destiné à être placé devant le nom IUPAC.
Pour les cycles cyclohexane di-substitués (à savoir deux groupes sur le cycle), l'orientation relative des deux substituants affecte l'énergie des conformations possibles. Pour le 1,2- et le 1,4-di-substitué, une configuration cis conduit à une axiale et un groupe équatorial. Cette configuration peut subir flipping chaise. Pour le 1,2- et le 1,4-di-substitué cyclohexane, une configuration trans conduit soit les deux groupes à la fois axial ou équatoriale. Dans ce cas, la conformation diaxiale est efficacement empêchée par sa forte contrainte stérique (quatre interactions gauches plus que le diequatorial). Pour le 1,3-di-substitués cyclohexanes, la forme cis est diequatorial et la conformation retournée subit une interaction stérique supplémentaire entre les deux groupes axiaux. Trans -1,3-di-substitué cyclohexanes sont comme cis -1,2- et cis -1,4- et peut basculer entre les deux axiaux équivalents / formes équatoriales.
Les dérivés de cyclohexane existent qui ont une conformation plus stable torsion bateau. Un exemple est le 1,2,4,5-tetrathiane, un composé organique soufré avec 4 groupes méthylène remplacé par un groupe sulfure éliminant ainsi les interactions défavorables 1,3-diaxiales. Dans l'analogue de tétraméthyl 3,3,6,6-tétraméthyl-1,2,4,5-tetrathiane la conformation torsion bateau domine réellement. Toujours dans le cyclohexane-1,4-dione avec l'interaction 1,4-hydrogène stérique enlevé, la conformation réelle est stable à la torsion bateau.
Cis-1,4-di-tert-butylcyclohexane a un groupe tert-butyle axial dans la conformation chaise et la conversion à la conformation torsion Bateau endroits les deux groupes dans des positions équatoriales plus favorables. En conséquence, la conformation de torsion bateau est plus stable de 0,47 kcal / mol (1,96 kJ / mole) à 125 K, tel que mesuré par spectroscopie RMN.
Effet du substituant polaire [citation requise]:
- cis-cyclohexane-1,3-diol préfère conformation diaxiale "formation de liaison intrahydrogen".
- 2,5-di-tert-butyl-1,4-cyclohexanediol présent sous forme bateau ou embarcation twist "aussi intra-H-bond"
- 2-bromocyclohexanone préfère-Br "répulsion min.dipolar"
- 2-bromo-4,4-diméthylcyclohexanone préfère e-Br « 1,3 interaction diaxiale (-ve dans e-Br) plus
répulsion dipolaire [citation nécessaire]:
- trans-1,2-dibromocyclohexane présent sous forme axiale dans des solvants non polaires « dipôles annuler »
tandis que dans la présente forme equtorial dans les solvants polaires « dipôles renforcent ».