Des accusations formelles, comment les travailler - Chimie Stack échange
Votre formule est correcte. Si $ V $ est le nombre d'électrons de valence attribuées à l'origine à un atome, $ N $ est le nombre d'électrons non liants, et $ B $ est le nombre de liaisons ($ \ frac $ du nombre d'électrons de liaison pour être plus précis ), alors la charge formelle $ de FC $ est:
ion a deux structures Sulfate valides que vous pourriez tirer, l'un avec du soufre ayant une charge formelle de zéro et un avec du soufre ayant une charge formelle de +2. Les structures ci-dessous (à partir de la page Wikipedia. Publié dans le domaine public) suivent la convention ennuyeux, mais permis de remplacer doublets avec des barres.
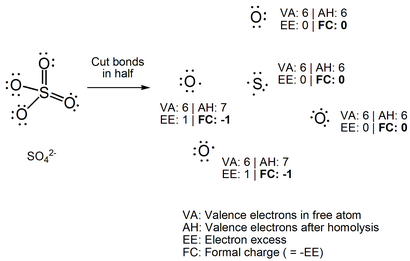
Si la structure à gauche (# 1) est correcte, alors l'atome de soufre ($ V = $ 6) comporte six liaisons ($ B = 6 $) et pas de paires isolés ($ N = 0 $). Deux atomes d'oxygène (V = 6) ont deux liaisons ($ B = $ 2) et deux paires isolés ($ N = 4 $), tandis que les atomes deux autres de l'oxygène ont une liaison ($ B = $ 1) et trois paires libres ($ N = 6 $). L'atome de soufre et deux atomes d'oxygène ont $ FC = 0 $ et les deux atomes d'oxygène restants ont $ FC = -1 $ pour une charge globale de l'ion de -2 $ $.
Si la structure à droite (n ° 2) est correcte, alors l'atome de soufre ($ V = $ 6) comporte quatre liaisons ($ B = $ 4) et aucune paire isolés ($ N = 0 $). Tous les quatre atomes d'oxygène (V = 6) ont une liaison ($ B = 1 $) et trois paires isolés ($ n = 6 $). L'atome de soufre a $ = FC + 2 $ et les atomes d'oxygène ont $ FC = -1 $ pour une charge globale de l'ion de -2 $ $. $$ FC _> = 6- (4 + 0) = + 2 $$ $$ FC _> = 6- (1 + 6) = - 1 $$
Mais attendez! Une question plus fondamentale pourrait être « Comment l'avoir ion sulfate deux structures très différentes qui met des charges formelles différentes sur les atomes de soufre et d'oxygène? »
charge formelle est un beau mécanisme de comptabilité, mais n'a pas de relation valide expérimentalement à la charge réelle sur tout atome dans la plupart des molécules ou des ions. charge formelle est égale à seulement la charge réelle sur les espèces monoatomiques. charge formelle tombe dans la catégorie des modèles que nous utilisons dans la chimie qui sont 1) utiles, 2) produisent la bonne réponse lorsqu'il est utilisé correctement, et 3) tout à fait faux. D'autres modèles de cette catégorie comprennent le nombre d'oxydation, VSEPR, résonance et électronégativité. Les données expérimentales suggèrent la structure réelle de sulfate combine les caractéristiques de la structure à la fois n ° 1 et de la structure n ° 2, mais serait difficile de tirer en utilisant les formalismes que nous avons adoptées:
- Tous les quatre $ \ ce obligations de $ sont égaux en longueur (# 2).
- La longueur des liaisons $ de \ $ de C'est plus courte qu'une simple liaison normale $ de CE \ et $ plus qu'un $ normale CE \ double $ (# 1).
- L'atome de soufre a une charge positive partielle (# 2) (note que les charges partielles, contrairement à des accusations formelles, ont une base expérimentale).
- Les quatre atomes d'oxygène sont équivalentes charges négatives partielles (# 2).
- Les charges négatives partielles sur les atomes d'oxygène ajouter à plus de $ -2 $, mais nulle part près de $ -4 $ (# 1).
La façon dont je l'ai appris, le nombre d'oxydation peut être déterminée par déterminer où les électrons de liaison assumerait les obligations sont ioniques à 100%, tandis que les frais officiels peuvent être déterminées par déterminer où les électrons seraient si la liaison était de 100% covalente .