Diffusion et la loi de Effusion Graham - Vidéo & Transcript Leçon
Avez-vous déjà été dans une pièce où quelqu'un a mis sur le parfum ou une lotion parfumée et quelques minutes plus tard, vous êtes en mesure de le sentir? Qu'est-ce que vous fait d'être en mesure de sentir quelque chose de si loin? Dans cette leçon, nous allons utiliser la théorie cinétique moléculaire des gaz pour expliquer certains de leurs comportements et de déterminer comment nous pouvons comparer les vitesses des différents gaz.
Théorie cinétique moléculaire
L'explication à cette question aromatique réside dans la théorie cinétique moléculaire. qui décrit le mouvement des particules de gaz parfaits. Il précise que les particules de gaz se déplacent constamment en mouvement aléatoire, rapide. Donc, si vous avez assez de particules (ou dans ce cas, les molécules d'odeur de cookies) dans un emplacement central, ils finiront par se propager parce qu'ils se déplacent au hasard et rapidement.
Le mot de la chimie de ce phénomène est la diffusion. qui est le mouvement d'une substance à travers une autre. En général, cela signifie que les particules se déploieront, ou passer d'une région de forte concentration dans une région de faible concentration. Dans mon exemple aux pépites de chocolat à biscuits, les particules de gaz qui contiennent les odeurs du biscuit se déplacent à travers l'air à partir d'une concentration élevée (la boulangerie) à une faible concentration (le trottoir et ses environs).
Après Johnny termine le cookie, il a acheté, il continue sa promenade. Un peu plus tard, il remarque quelque chose de particulier son ballon: il semble couler. Ce qui était autrefois un ballon d'hélium de haut vol est maintenant juste un vol stationnaire et le ballon légèrement plus petit. Que pensez-vous a causé le ballon de Johnny à perdre une partie de son hélium?
Eh bien, un phénomène appelé épanchement est à blâmer. Épanchement est lorsque des particules de gaz sortent à travers de petits trous dans un récipient. Épanchement se produit pour la même raison que la diffusion: des particules de gaz se déplacent dans un mouvement aléatoire, rapide. Parce que les atomes d'hélium sont si petit et léger (l'hélium est le plus léger gaz non inflammable), les particules peuvent facilement échapper à travers les trous microscopiques dans le ballon, ce qui provoque le ballon pour obtenir de plus en plus dense, ce qui fait couler.
La loi de Graham
Graham a déterminé que les molécules de gaz plus légers se déplacent plus vite que les molécules de gaz plus lourds.
Dans les années 1800, Thomas Graham expérimenta avec effusion et a découvert une relation très importante: les molécules de gaz plus légers voyager plus vite que les molécules de gaz plus lourds.
Donc, en supposant que la température et la pression restent constantes, atomes ou des molécules ayant une masse moléculaire plus faible va effuse plus rapidement que des atomes ou des molécules ayant une masse moléculaire plus élevée. Graham est même allé plus loin en savoir combien plus rapidement une molécule serait sur une autre.
Cela est devenu connu comme la loi de Graham. et il indique que le taux d'effusion d'un gaz est inversement proportionnelle à la racine carrée de sa masse moléculaire. Habituellement, cette formule est utilisée lorsque l'on compare les taux de deux différents gaz à des températures et des pressions égales. Le rapport de la vitesse (ou vitesse) de gaz par rapport au gaz B est égal à la racine carrée de la masse de gaz B sur la masse de gaz A.
Problème pratique 1
Alors, essayons d'utiliser cette équation avec le scénario suivant: Si les molécules d'oxygène effuse à un taux moyen de 3 mol / s, comment rapide des molécules d'hydrogène effuse dans exactement les mêmes conditions?
Commençons en remplissant les informations que nous savons, et nous appellerons l'hydrogène « gaz A » et de l'oxygène « gaz B ». On sait que le taux de gaz B est de 3 mol / s et la masse moléculaire de l'oxygène (un élément diatomique) est de 32 amu. La masse moléculaire de l'hydrogène (également diatomique) est de 2 amu.
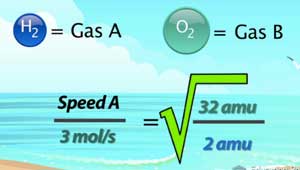
Ma première étape dans la résolution est de calculer le côté droit de l'équation. 32 divisé par 2 est 16. Remarquez comment les unités annulent. La racine carrée de 16 est 4. Pour résoudre pour x, nous devons simplement multiplier les deux côtés par 3 mol / s, ce qui nous donne une réponse de 12 mol / s. Donc, si l'oxygène est épanché à un débit de 3 mol / s, un atome d'hydrogène serait épanché 4 fois plus rapide à un taux de 12 mol / s.
déverrouiller contenu
Plus de 55 000 leçons dans tous les sujets majeurs
Accès GRATUIT pour 5 jours,
il suffit de créer un compte.
Aucune obligation, annuler à tout moment.
Sélectionnez un sujet à des cours liés à l'aperçu:
Il est important de mentionner que les unités de chaque côté ne sont pas importants aussi longtemps qu'ils sont les mêmes. Sur le côté gauche de l'équation, vous pouvez utiliser toutes les unités de taux (de moles par seconde, molécules par seconde, mètres par seconde, miles par heure) et sur le côté droit de l'équation des unités de masse pourraient être utilisés (AMU pour le moléculaire masse ou g / mol pour la masse molaire). Il vous suffit de vous assurer que les unités sur le dessus et le fond des fractions sont les mêmes. Cette formule fonctionne bien pour trouver le taux d'épanchement dans de nombreuses situations, et il est une bonne approximation pour comparer les taux de diffusion de deux gaz.
Pratique Problème 2
Pour ce dernier problème, nous allons comparer les taux d'éthanol (un ingrédient commun dans le parfum), C2H6O, et de l'ammoniac, NH3. Si une bouteille de chacun ont été ouvert à une certaine distance de vous, lequel seriez-vous sentir d'abord?
Nous ne aurions pas besoin de mettre en place l'équation pour répondre à cette question - nous juste besoin de déterminer lequel est le plus léger, mais nous allons mettre en place l'équation juste pour obtenir un peu de pratique supplémentaire. Alors, commençons en affectant l'ammoniac comme « gaz A » et de l'éthanol comme « gaz B. » Les masses moléculaires en substituant de chacun sur le côté droit de l'équation nous donne la racine carrée de 46 divisé par 17. Si l'on calcule, nous obtenons environ 1,6. Cela signifie que l'ammoniac voyagera 1,6 fois plus rapide que l'éthanol, et vous sentir l'ammoniac avant de sentir le parfum!
Les particules de gaz sont constamment en mouvement dans un mouvement aléatoire et rapide, ce qui les amène à se diffuser et effuse. Johnny a pu sentir ces biscuits aux pépites de chocolat en raison de la diffusion. l'odeur de biscuit est devenu plus étalé. Le ballon Johnny tenait devient plus petit à cause de l'effusion. l'hélium dans le ballon échappé par de petits trous dans les parois du ballon. Loi de l'effusion de Graham concerne les taux d'épanchement à la masse de la substance. Ainsi, lorsque l'on compare deux gaz, les taux relatifs d'épanchement ou de diffusion sont inversement proportionnels aux racines carrées de leurs masses.
Résultats d'apprentissage
Après cette leçon, vous serez en mesure de:
- Définir la diffusion et l'effusion
- Expliquer la loi de Graham
- Résoudre les problèmes de la pratique en utilisant la loi de Graham
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.