Gram positif S
Tirer le meilleur parti de la recherche scientifique et l'information de nos 700+ examinés par les pairs revues en accès libre qui fonctionne avec l'aide de membres 50.000+ comité de rédaction et estimé examinateurs et 1000+ Les associations scientifiques en médecine, clinique, pharmaceutique, Ingénierie, Technologie et Management Des champs.
Rencontrez inspirantes conférenciers et experts à nos 3000+ mondiaux Conferenceseries événements avec plus de plus de 600 conférences, 1200+ et 1200+ Symposiums Ateliers sur
Médical, Pharma, Ingénierie, Sciences, Technologie et affaires
Article de recherche Open Access
Gail Czarnecki 2. Prabani Dissanayake 1 et Sunil Palchaudhuri 1 *
1 Département d'immunologie et de microbiologie, Wayne State University, School of Medicine, Detroit, MI, USA
2 Département de Orthodontie et dentisterie pédiatrique, Université du Michigan, École de médecine dentaire, Ann Arbor, MI, USA
Le temps de génération de diplococcic streptococcus viridans groupe. S. mitis est anormalement prolongée lorsqu'elle est cultivée dans un bouillon riche contenant du xylitol (2% ou des concentrations plus élevées). Ces streptocoque exposés xylitol se développent principalement dans les chaînes de longueurs différentes avec l'hétérogénéité de la couleur: rose, violet et rose et violet combiné. La partie rose de ces chaînes bactériennes semble être plus mince que la portion pourpre indiquant une réduction de l'épaisseur de la paroi cellulaire. À l'appui de la microscopie optique, microscopie électronique à balayage de la même population bactérienne démontre une réduction considérable de la taille, mais encore dans les chaînes. Dans ces chaînes, il y a une variation de taille, indiquant que tous les membres du diplococcic S. population mitis ne sont pas également touchés. Apparemment, la population viable partiellement affectée de S. mitis, devient sensible à la colistine et de l'acide nalidixique lorsqu'il est cultivé dans xylitol.
xylitol; épaisseur de la paroi cellulaire; S. mitis; colistine; l'acide nalidixique; Microscopie électronique
introduction
En 1928, le Dr Fred Griffith a enregistré dans son rapport de pathologie que les deux types de colonies, des colonies rugueuses et lisses de S. pneumonie sont observés dans un milieu de croissance solide microbiologique (par exemple plaque de gélose au sang). Jusqu'à présent, ces colonies n'ont pas été analysés de façon appropriée. Cependant, de telles variations morphologiques (opaques et transparentes) des colonies bactériennes sont également pour plusieurs diplococcic pathogènes Gram-positifs, y compris S. mutans (dentaires) et S. mitis. De manière significative, ces diplococcic pathogènes Gram-positives ont une faible teneur en G-C (< 40%) but they differ in their pathogenesis. In support of our statement, it has been known that the virulence associated proteins CBP’s, CbpA, PspA and PepA are found only in S. pneumoniae except S. mitis is phylogenetically related to S. pneumonia [1 ,2 ]. Above all, this pathogen is becoming increasingly resistant to modern medicines, antibiotics and surface antigen based polyvalent vaccines and therefore, the disease “bacterial pneumonia” has created a new concern. In order to save children from pneumonia, alternative therapies which affect bacterial genetic ability used to communicate among the members of their own community are urgently needed. Signal based communication is also controlling their gene transfer ability.
Matériaux et méthodes
Une culture génétiquement pure de S. mitis en infusion de coeur du cerveau (BHI) a été cultivé pendant une nuit dans un pot de CO2. Après environ 24 heures, la culture a été diluée à 10 -4 et 10 -5 dans BHI et a permis de se développer pendant 2 à 3 heures. Ensuite, 0,1 ml de chaque dilution a été étalé sur de la gélose trypticase soja (TSA), et TSA contenant de la colistine et nalidixique plaques d'acide (CNA), et incubées pendant 24 à 72 heures dans trois conditions différentes: a) 37 ° C sans CO2. b) 37 ° C avec du CO2 et c) 25 ° C (température ambiante). Le titre était le même dans les trois conditions. Nous avons utilisé 2 différentes souches obtenues à partir de la collection ATCC: ATCC 6249 (étroitement liés à S. pneumoniae) et S. mutans: ATCC 25175 (agent pathogène de soins dentaires). Il est intéressant de S. mutans présente un problème de croissance à un pH supérieur à 7 (données non publiées).
Pour établir la courbe de croissance pour S. mitis, toutes les cultures d'une nuit dans du milieu BHI ont été dilués 1:50 en ajoutant 0,1 ml de chaque culture dans deux tubes séparés contenant 4,0 ml de BHI frais et laissées se développer à 37 ° C dans un bain d'eau shaker. Des échantillons ont été prélevés à cinq intervalles de temps différents et chaque échantillon dilué à 10 -4 dans une solution saline tamponnée au phosphate. Après dilution, 0,1 ml de chaque culture a été étalée sur des plaques de TSA et incubée à 37 ° C. Le titre bactérien a été déterminée sur un milieu gélose solide en comptant les unités formant colonie (UFC). La courbe de croissance pour S. mitis dans 2% a été créé par xylitol la préparation d'une culture de la nuit dans BHI et l'incubation dans un pot de bougie pendant 24 heures. Cette culture a été diluée 100 fois. Ensuite, 1 ml a été transféré dans deux tubes séparés. Le premier tube est un contrôle auquel rien n'a été ajouté. Pour le second tube, 0,1 ml d'une xylitol à 20% (solution mère) a été ajouté. Les deux tubes ont été incubés dans un bain-marie à 37 ° C avec agitation par secousses. Des échantillons ont été prélevés à différents intervalles de temps. A chaque intervalle, de 0,1 ml a été diluée à 10 -3 ou -4 10 dans une solution saline tamponnée au phosphate et étalées sur des plaques de TSA et de CNA. Les plaques ont été incubées à 37 ° C et les colonies ont été comptées au bout de 24 heures. La croissance logarithmique des bactéries a été surveillée par comptage des colonies pour déterminer le nombre d'unités formant des colonies dans des milieux de gélose riche (solides). Il n'y avait pas de lyse hémolysés ou bactéries intactes dans les milieux de gélose au sang. Les procédures MIC pour examiner la modification des modèles de sensibilité aux antibiotiques induite par la présence de xylitol dans les milieux de croissance S. mitis ont également été modifié [14].
La microscopie électronique à balayage (SEM)
S. mitis a été cultivée dans du BHI contenant 2% de xylitol pour une nuit à 37 ° C, et fixé avec 2,5% de glutaraldéhyde. L'échantillon a été lavé successivement avec 25% d'éthanol absolu. Après l'observation d'or pendant 5 secondes, l'échantillon a été visualisé sous JEOL JSM-7600F à 15 kV [15].
modèle de croissance Altered de S. mitis
Figure 1: Courbes de croissance de streptocoques du groupe viridans (S. mitis) à 0% de xylitol et 2% de xylitol.
altération Xylitol induite par la sensibilité aux antibiotiques
Nous avons augmenté le S. mitis dans un bouillon riche avec diverses concentrations de xylitol (0% à 6%) à partir du début de la phase log-saturation (10 4 / ml à 10 9 / ml) (Figure 1). Les bactéries exposées Xylitol ont ensuite été répartis sur trois différents milieux de croissance: gélose au sang, TSA et TSA contenant des antibiotiques colistine et d'acide nalidixique (CNA). Après 24 heures d'incubation à 37 ° C avec ou sans CO2. un nombre à peu près égal de colonies a augmenté dans les trois médias; mais, colonies sur CNA étaient beaucoup plus petite taille par rapport aux colonies cultivées sur gélose au sang et les médias TSA qui ne contenaient pas d'antibiotiques. Lorsque nous avons transféré ces petites colonies (la technique de Lederberg) à une autre plaque fraîche CNA contenant 2% de xylitol, les colonies transférées ont montré un effet inhibiteur grave et est devenu visible que les micro-colonies après 48 heures d'incubation à 37 ° C. Ces données conduit à la conclusion que ces micro-colonies sont dues à l'inhibition complète de la multiplication des cellules (ou la division cellulaire), ou les deux, et l'utilisation partielle de xylitol les a rendus sensibles à l'action combinée des antibiotiques, la colistine et la nalidixique acide (1 pg / ml chacun). La colistine et l'acide nalidixique pourraient atteindre leurs cibles situées dans la membrane de S. mitis après leur croissance pour 5-7 générations à 2% de xylitol. Cependant, cet effet inhibiteur était beaucoup moins lorsque ces antibiotiques ont été ajoutés séparément. Pour confirmer cette observation, un test de dilution en gélose a été réalisée après la modification nécessaire du protocole de Baker et al. comme indiqué ci-dessous [14].
La mesure de la sensibilité aux antibiotiques par MIC
Dans l'essai de dilution en gélose, les bactéries ont été diluées dans du bouillon Muller-Hinton pour atteindre un titre de environ 10 6 UFC et réparties sur la surface du milieu TSA [2]. Dans notre expérience, ces plaques de TSA contenaient diverses concentrations d'antibiotiques (0% à 100 ug / ml), la colistine et d'acide nalidixique séparément ou ensemble. Cependant, les solutions mères de ces deux antibiotiques ont été préparées dans de l'eau distillée stérile et filtrés à travers des disques de filtre Millipore, avec une taille de pores de 2 um. Après autoclavage, le milieu TSA solide agar a été refroidi à 47 ° C en les laissant dans un bain d'eau pendant 45 minutes et ensuite différentes concentrations d'antibiotiques ont été ajoutées (tableau 1). Nous avons également enregistré que les médias de l'AIIC disponibles dans le commerce contenant ces antibiotiques perdent leur puissance après autoclavage, mais encore à Gram négatif E. coli K-12, S. typhimurium et de nombreuses bactéries aéroportées ne montrent aucune croissance au cours de leur stockage à température ambiante ou même après 48 heures d'incubation à 37 ° C avec ou sans CO2. À l'appui de cette observation, les bactéries Gram-positif S. mitis sont conditionnellement devenir sensibles aux antibiotiques comme le prouve la formation de micro-colonies en présence de colistine (polymixine B ou E) et de l'acide nalidixique lorsqu'il est utilisé en combinaison (tableau 1) .
Les bactéries cultivées avec et sans 2% xylitol
TSA avec colistine et de l'acide nalidixique
Tableau 1: sensibilité aux antibiotiques de S. mitis dans 2% de xylitol, telle que mesurée par le test de dilution en gélose.
Comparaison de S. mitis Grown par microscopie xylitol optique et SEM
A toutes les concentrations de xylitol, les bactéries sont également cultivées à saturation (5 heures) avec et sans agitation. Lorsque ces populations exposées xylitol sont visualisés par siècle technique ancienne coloration de Gram, la plupart des bactéries se développent dans les chaînes et afficher une combinaison de couleurs à la fois pourpre et rose et un très petit nombre d'individus de diplococcic violets (figure 2B). De toute évidence, le segment rose de la même chaîne violette apparaît très mince et fragile. Le défaut de cristal violet à interagir de manière stable avec les bactéries Gram-positives cultivées xylitol conduit à la conclusion que l'épaisseur de la paroi cellulaire a été affectée. analyse SEM de la même population exposée à 2% confirme leur présence xylitol dans une longue chaîne, mais l'hétérogénéité des tailles (figure 3B). La figure 3A montre le contrôle bactérien sans xylitol. Dans la figure 3B, il y a quelques bactéries plus grandes dans la même chaîne. Ce sont probablement les vivants qui ont été partiellement touchées par xylitol, mais sont encore capables de colonies formant [12]. Ces colonies deviennent sensibles à l'acide nalidixique et la colistine lorsqu'il est utilisé en combinaison (tableau 1). Dans le même micrographie il y a une présence de parent diplococcic de taille normale (environ 1,8 um). Les valeurs de densité optique à 580 um ont montré aucune différence entre le contrôle et la population exposée 2% xylitol. De plus, les valeurs de densité optique ne montrent aucune différence indiquant aucune lyse.
Figure 2A et B: coloration de Gram de contrôle S. mitis (A) et (B) exposée à 2% de xylitol. La figure 2B montre S. mitis dans les chaînes avec une combinaison de couleurs. Ils représentent deux phases de croissance différentes et donc leur diffère de titre.
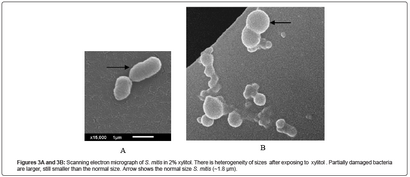

Figure 3A et 3B: Micrographie électronique à balayage de S. mitis dans 2% de xylitol. Il existe une hétérogénéité des tailles après l'exposition au xylitol. Partiellement les bactéries endommagées sont plus grandes, encore plus petite que la taille normale. La flèche indique la taille normale S. mitis (
Discussion
Remerciements
Nous tenons à remercier le Dr A. Palchaudhuri pour le soutien financier partiel et ses connaissances en microbiologie clinique.
Les références
Choisissez votre langue d'intérêt pour voir la teneur totale dans votre langue intéressé