la chimie des fullerènes
la chimie des fullerènes est un domaine de la chimie organique consacrée aux propriétés chimiques des fullerènes. [1] [2] [3] La recherche dans ce domaine est dicté par la nécessité de fonctionnaliser fullerènes et à adapter leurs propriétés. Par exemple, le fullerène est notoirement insoluble et l'addition d'un groupe approprié peut améliorer la solubilité. [1] L'ajout d'un groupe polymérisable, un polymère de fullerène peut être obtenu. fullerènes fonctionnalisés sont divisés en deux classes: les fullerènes exohedral avec des substituants en dehors de la cage et les fullerènes endohédraux avec des molécules piégées à l'intérieur de la cage.
Cet article porte sur la chimie des fullerènes, tandis que la chimie des nanotubes de carbone est couvert dans la chimie des nanotubes de carbone.
propriétés chimiques de fullerènes Modifier
En raison de la forme sphérique de la molécule des atomes de carbone sont hautement pyramidalized. qui a des conséquences importantes pour la réactivité. On estime que l'énergie de déformation constitue 80% de la chaleur de formation. Les atomes de carbone conjugués répondent à l'écart de planéité par réhybridation orbital des orbitales sp² et orbitales pi à un sp 2,27 orbital avec un gain en caractères p. Les lobes p étendent plus loin en dehors de la surface qu'ils ne le font à l'intérieur de la sphère, et c'est l'une des raisons pour lesquelles un fullerène est électronégatif. L'autre raison est que les * vides pi basses ont aussi le caractère orbitals d'un haut.
Les doubles liaisons dans fullerène ne sont pas tous les mêmes. Deux groupes peuvent être identifiés: 30 soi-disant [6,6] doubles liaisons relient deux hexagones et 60 [5,6] obligations connecter un hexagone et un pentagone. Sur les deux les [6,6] obligations sont plus courtes avec plus de caractère double liaison et donc un hexagone est souvent représenté comme un cyclohexatriène et un pentagone comme pentalène ou [5] radialène. En d'autres termes, bien que les atomes de carbone en fullerènes sont tous conjugués à la superstructure est pas un composé super-aromatique. Les valeurs de longueur obligations de diffraction des rayons X sont 139,1 pm pour le [6,6] et 145,5 pm liaison pour la liaison [5,6].
Fullerène C60 a 60 électrons pi, mais une configuration shell fermée nécessite 72 électrons. Le fullerène est en mesure d'acquérir, par réaction avec les électrons manquants potassium pour former le premier K
6 C 6-
60 sel, puis le K
12 C 12-
60 Dans ce composé, le alternance de longueur de la liaison observée dans la molécule parente a disparu.
Les fullerènes ont tendance à réagir comme électrophiles. Une force d'entraînement supplémentaire est le soulagement de la contrainte lorsque des doubles liaisons sont saturées. Clé dans ce type de réaction est le niveau de fonctionnalisation à-dire monoaddition ou des additions multiples et en cas de multiples additions leurs relations topologiques (nouveaux substituants entassés ou uniformément espacés). En conformité avec les règles de l'IUPAC, les termes méthanofullerène sont utilisés pour indiquer les anneaux fermés (cyclopropane) des dérivés de fullerène, et fulleroid à cycle ouvert (structures de methanoannulene). [7] [8]
Modifier d'addition nucléophiles
Les fullerènes réagissent comme électrophiles avec un hôte de nucléophiles dans les additions nucléophiles. L'intermédiaire carbanion formé est capturé par un autre électrophile. Des exemples de nucléophiles sont des réactifs Grignard et réactifs organolithiens. Par exemple, la réaction de C60 avec du chlorure de méthylmagnésium arrête quantitativement au penta-produit d'addition avec les groupes méthyle centrés autour d'un anion cyclopentadiényle qui est ensuite protoné. [9] Une autre réaction nucléophile est la réaction Bingel. Fullerène réagit avec le chlorobenzène et le chlorure d'aluminium dans une réaction de type d'alkylation de Friedel-Crafts. Dans ce hydroarylation le produit de réaction est le produit d'addition 1,2-addition (Ar-CC-H). [dix]
Réactions péricycliques Modifier
Les [6,6] liens de fullerènes réagissent comme des diènes ou des diénophiles dans cycloadditions par exemple des réactions de Diels-Alder. anneaux 4 chaînons peuvent être obtenus par [2 + 2] cycloadditions par exemple avec benzyne. [11] [12] Un exemple d'une cycloaddition 1,3-dipolaire d'un cycle à 5 chaînons est la réaction Prato.
Modifier hydrogénation
Les fullerènes sont facilement hydrogènes par plusieurs méthodes. Des exemples de hydrofullerenes sont C60 H18 et C60 H36. Cependant, complètement hydrogénée C60 H60 est hypothétique en raison de grandes déformations. fullerènes fortement hydrogénées ne sont pas stables, comme l'hydrogénation prolongée de fullerènes par réaction directe avec de l'hydrogène gazeux dans des conditions de température élevée conduit à une fragmentation de la cage. Au stade final de la réaction ce qui provoque l'effondrement de la structure de cage avec formation d'hydrocarbures aromatiques polycycliques. [13]
oxydation Modifier
Bien plus difficile que la réduction, l'oxydation de fullerène est possible, par exemple, avec de l'oxygène et tétraoxyde d'osmium.
hydroxylation Modifier
Les fullerènes peuvent être hydroxylés à fullerenols ou fullerols. Solubilité dans l'eau dépend du nombre total de groupes hydroxyle qui peuvent être attachés. Un procédé est la réaction de fullerène dans de l'acide sulfurique dilué et de nitrate de potassium à C60 (OH) 15. [14] [15] Un autre procédé est la réaction dans de l'hydroxyde de sodium dilué catalysée par TBAH ajoutant 24 à 26 groupes hydroxyle. [16] L'hydroxylation a également été rapportée en utilisant du NaOH / peroxyde d'hydrogène sans solvant. [17] C60 (OH) 8 a été préparé en utilisant une procédure en plusieurs étapes à partir d'un fullerène de peroxyde mixte. [18] Le nombre maximal de groupes hydroxyle qui peuvent être fixés (méthode de peroxyde d'hydrogène) se dresse à 36-40. [19]
Modifier d'addition électrophile
additions rétro Modifier
Des protocoles ont été étudiés pour éliminer les substituants par retroadditions après avoir purgé leur but. Les exemples sont la réaction rétro-Bingel et la réaction rétro-Prato.
additions carbène Modifier
ajouts radicaux Modifier
Les fullerènes peuvent être considérés comme des piégeurs de radicaux. [23] [24] Avec un radical hydrocarboné simple tel que le radical t-butyle obtenu par thermolyse ou photolyse d'un précurseur approprié, le radical tBuC60 est formé qui peut être étudié. L'électron non apparié ne pas délocaliser sur l'ensemble de la sphère, mais prend des positions à proximité du substituant tBu.
Fullerènes en tant que ligands Modifier
Fullerène est un ligand en chimie organométallique. La [6,6] double liaison est déficient en électrons et forme habituellement des liaisons métalliques avec η = 2 hapticité. modes de liaison tel que η = 5 ou η = 6 peut être induite par une modification de la sphère de coordination.
fullerènes open-cage Modifier
Modifier Heterofullerenes
dimères fullerènes Modifier
Les cycloaddition d'un bucky C120 haltère C60 fullerène dimérise dans un formel [2 + 2] à l'état solide par mécanochimie (fraisage de vibration à grande vitesse) avec du cyanure de potassium en tant que catalyseur. [46] Le trimère a également été rapporté en utilisant la 4-aminopyridine à titre de catalyseur (4% de rendement) [47] et observées par microscopie à effet tunnel en monocouche. [48]
Modifier la synthèse de plusieurs étapes de fullerène
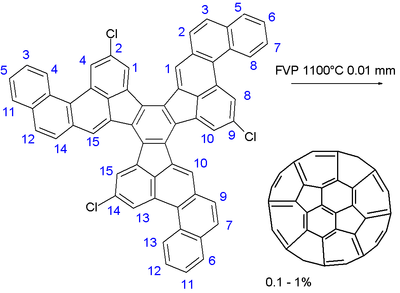
Dans l'étape finale d'un grand hydrocarbure aromatique polycyclique composé de 13 hexagones et pentagones trois a été soumis à clignoter pyrolyse sous vide à 1100 ° C et 0,01 Torr. Les trois liaisons de chlore de carbone ont servi d'incubateurs de radicaux libres et la balle a été piquées dans une série complexe de réactions radicales sans doute. Le rendement chimique est faible: 0,1 à 1%. Un petit pourcentage de fullerènes est formée dans un processus qui implique la combustion d'hydrocarbures, par exemple, en bougie allumée. Le rendement par un procédé de combustion est souvent supérieure à 1%. La méthode proposée ci-dessus ne fournit aucun avantage pour la synthèse de fullerènes par rapport à la méthode de combustion habituelle, et par conséquent, la synthèse organique de fullerènes reste un défi pour la chimie.
purification de fullerènes est le processus d'obtention d'un composé de fullerène exempt de contamination. Dans les mélanges de production de fullerènes C60. C70 et sont toujours homologues supérieurs formés. purification de fullerène est la clé de la science et de fullerène détermine les prix de fullerène et le succès des applications pratiques de fullerènes. La première méthode de purification disponible pour fullerène C60 était par HPLC à partir de laquelle de petites quantités pourraient être produits à grande dépense.
Un procédé en laboratoire pratique pour la purification de suie enrichie en C60 et C70 commence par extraction dans du toluène suivie d'une filtration avec un filtre en papier. Le solvant est évaporé et le résidu (la fraction de suie soluble dans le toluène) redissous dans du toluène et soumis à une Chromatographie sur colonne. C60 d'abord avec une élué couleur pourpre et C70 est à côté l'affichage d'une couleur brun rougeâtre. [53]
Dans nanotube de traitement du procédé de purification mis en place pour éliminer le carbone amorphe et les métaux est compétitif par oxydation (souvent l'acide sulfurique / mélange d'acide nitrique). On suppose que cette oxydation crée des groupes contenant de l'oxygène (hydroxyle. Carboxyle carbonyle.) Sur la surface du nanotube qui stabilisent les électrostatiquement dans l'eau et qui peuvent ensuite être utilisées dans la fonctionnalisation chimique. Un rapport [54] révèle que les groupes contenant de l'oxygène en réalité se combinent avec de carbone absorbé contaminations à la paroi nanotube qui peut être enlevé par un lavage de base simple. Les nanotubes nettoyés auraient réduit le rapport D / G indicative de moins fonctionnalisation, et l'absence d'oxygène est également apparent à partir de la spectroscopie IR et la spectroscopie photoélectronique à rayons X.
stratégies de purification expérimentale Modifier
Une stratégie de purification de fullerènes récente à l'échelle du kilogramme a été démontrée par Nagata et al. [55] Dans ce procédé C60 a été séparé d'un mélange de C60. C70 et les composés de fullerènes supérieurs en ajoutant d'abord le composé amidine DBU dans une solution du mélange dans le 1,2,3-triméthylbenzène. DBU il se trouve seulement réagit à C70 et des fullerènes ultérieure des produits de la réaction se séparent et peuvent être éliminés par filtration. fullerènes C60 n'ont pas d'affinité pour DBU et sont ensuite isolés. D'autres composés diamine comme DABCO ne partagent pas cette sélectivité.
C60 mais pas C70 forme 1: 2 composé d'inclusion avec la cyclodextrine (CD). Procédé de séparation pour les deux fullerènes basés sur ce principe est rendu possible par l'ancrage cyclodextrine à des particules d'or colloïdal à travers un soufre -sulfur pont. [56] Le composé de Au / CD est très stable et soluble dans l'eau et extrait sélectivement C60 à partir du mélange insoluble après chauffage au reflux pendant plusieurs jours. Le composant de fullerène C70 est ensuite éliminé par simple filtration. C60 est entraîné à partir du composé Au / CD en ajoutant adamantol qui a une affinité plus élevée pour la cavité de la cyclodextrine. Au / CD est complètement recyclée lorsque adamantol à son tour, est entraîné par l'addition d'éthanol et de l'éthanol est éliminé par evaporation; 50 mg de Au / CD capture 5 mg de fullerène C60.