Les réactions chimiques (procédure) Classe 9 Chimie Amrita Lab en ligne
: inférences
- Le magnésium est un métal blanc argenté qui brûle dans l'air et utilise l'oxygène atmosphérique de l'air pour former de l'oxyde de magnésium.
- L'oxyde de magnésium change la couleur du papier de tournesol rouge au bleu. Cette réaction montre que l'oxyde de magnésium est de nature basique.
- La formation de l'oxyde de magnésium est une réaction de combinaison directe de deux éléments: le magnésium et l'oxygène. L'oxyde de magnésium est tout à fait différent du magnésium réactifs et de l'oxygène. Ainsi, cette réaction est un changement chimique.
précautions:
- La surface du ruban de magnésium doit être correctement nettoyée avec du papier de sable.
- Le frêne blanc d'oxyde de magnésium ne doit pas être touché.
- ruban de magnésium doit être maintenu par une paire de pinces en brûlant.
- Il est préférable d'utiliser des lunettes de soleil pour protéger les yeux de la lumière éblouissante de brûler ruban de magnésium.
Matériaux nécessaires:
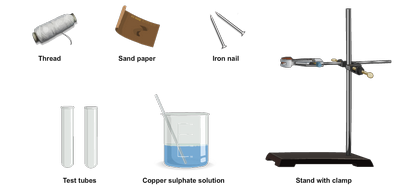
Lab Procédure:
- Nettoyer les deux clous de fer de taille suffisante en frottant avec du papier de sable pour que leur couleur apparaît grisâtre.
- Prendre une quantité suffisante de solution de sulfate de cuivre dans deux tubes à essai et fixer un tube à essai dans chaque cage.
- Attachez un clou de fer avec un fil et l'accrocher dans un tube à essai de sorte qu'il est complètement immergé dans une solution de sulfate de cuivre. Attachez l'autre extrémité du fil avec le support.
- Gardez l'autre clou dans une boîte de Pétri de comparaison après l'expérience.
- Gardez les deux tubes à essai au repos pendant environ 15 min.
- Après 15 min. retirer le clou de fer immergé dans une solution de sulfate de cuivre et le mettre dans la boîte de Pétri.
observations:
- Il y a un revêtement brun sur l'ongle de fer qui a été plongé dans la solution de sulfate de cuivre, alors que le clou de fer placé dans un plat de Pétri montre la couleur gris de fer.
- La couleur de la solution de sulfate de cuivre dans lequel le clou de fer a été plongé devient verdâtre léger, alors que la solution de sulfate de cuivre dans l'autre tube à essai ne change pas.
: inférences
- Ceci est une simple réaction de déplacement dans lesquelles le cuivre a été déplacé par le fer de la solution de sulfate de cuivre et d'un nouveau composé, le sulfate ferreux, est formée. Ainsi, cette réaction est un changement chimique.
précautions:
- Nettoyez les clous de fer en les frottant avec du papier de sable pour enlever la rouille, de la poussière ou de la surface grasse.
- Gardez l'expérience de contrôle pour comparer la couleur des ongles de fer et d'une solution de sulfate de cuivre.
- Évitez de toucher une solution de sulfate de cuivre ou d'un clou trempé dans une solution de sulfate de cuivre. Comme le sulfate de cuivre est toxique.
Matériaux nécessaires:

Lab Procédure:
- Prendre une petite quantité de cristaux de sulfate de cuivre dans un tube d'ébullition à sec.
- Tenir le tube bouillante avec un support de tube à essai.
- Chauffer le tube bouillant au-dessus de la flamme d'un brûleur d'abord doucement, puis fortement.
- Observer la couleur des cristaux de sulfate de cuivre après le chauffage pendant un certain temps.
- Notez les gouttelettes d'eau le long des côtés du tube d'ébullition.
- Retirer le tube d'ébullition de la flamme et laisser refroidir.
- Ajouter 2-3 gouttes d'eau sur l'échantillon de sulfate de cuivre obtenu après chauffage.
observations:
- Le chauffage, la couleur des cristaux de sulfate de cuivre passe du bleu au blanc.
- Il y a des gouttelettes d'eau sur les parois du tube d'ébullition.
- En ajoutant 2-3 gouttes d'eau sulfate de cuivre blanc devient bleu.
: inférences
- cristaux de sulfate de cuivre contiennent de l'eau de cristallisation (CuSO4 .5H2 O).
- Le chauffage, le sulfate de cuivre hydraté perd sa molécule d'eau et forme du sulfate de cuivre anhydre de couleur blanche.
- En ajoutant des changements de sulfate de cuivre anhydre de l'eau au sulfate de cuivre hydraté.
- Il est un changement chimique réversible.
précautions:
- Gardez la bouche du tube d'essai de votre visage et aussi d'autres camarades de classe.
- Toujours utiliser support de tube d'essai tout en chauffant le tube à essai.
- Prenez une petite quantité de cristaux de sulfate de cuivre.
Matériaux nécessaires:
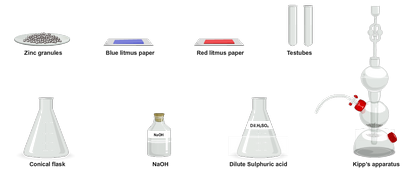
Lab Procédure:
- Prenez une petite quantité de DIL. H2 SO4 dans un flacon conique.
- Ajouter une petite quantité de granulés de zinc à elle.
- Amener un papier de tournesol bleu et rouge humide près de l'embouchure de la fiole conique d'une par une.
- Cork le flacon avec un bouchon ennuyé et une insertion d'un tube de jet à travers le trou dans le bouchon.
- Apportez une bougie allumée près de l'embouchure de l'amende tube jet.
- Verser une petite quantité de la solution du flacon conique dans un tube à essai.
- Ajouter quelques gouttes de solution d'hydroxyde de sodium en elle. Un précipité gélatineux blanc est formé.
- Ajouter excès de NaOH dans le précipité gélatineux.
- Le précipité est soluble dans un excès de NaOH.
- Prenez une petite quantité de la solution dans un autre tube à essai et passer le gaz H2 de travers à l'aide de l'appareil de Kipp.
- Un précipité blanc se forme.
observations:
- Après avoir ajouté des granulés de zinc à DIL. évolution H2 SO4 de bulles de gaz se produit.
- Le gaz sortant ne change pas la couleur des papiers de tournesol bleu et rouge.
- En portant la flamme, le gaz sortant du tube de jet brûle instantanément avec une petite explosion et produire un son pop et la flamme plonge dehors.
- Par addition de NaOH à la petite quantité de solution prélevé du flacon conique, précipité gélatineux blanc est formé qui est soluble dans un excès de NaOH.
- Lors du passage du gaz de sulfure d'hydrogène à travers la solution adoptée dans le tube à essai est formé un précipité blanc.
: inférences
- Le zinc réagit avec dil.H2 SO4 pour former du sulfate de zinc et le dégagement d'hydrogène gazeux.
- Le test avec des papiers de tournesol rouge et bleu montre que le gaz d'hydrogène est ni acide, ni basique dans la nature.
- NaOH réagit avec ZnSO4 pour former un précipité gélatineux blanc d'hydroxyde de zinc (Zn (OH) 2) qui est soluble dans un excès de NaOH.
- ZnSO4 réagit avec H2 S pour former un précipité blanc de sulfure de zinc (ZnS).
- Le zinc est plus réactif que l'hydrogène.
- Ceci est une simple réaction de déplacement d'un non-métal d'un métal.
- ZnSO4 est tout à fait différente de la composition chimique et les propriétés chimiques que Zn et H2 SO4. Il est donc un changement chimique
précautions:
- Utilisez les produits chimiques judicieusement.
- Ne pas inhaler les gaz dégagés directement.
- De l'hydrogène gazeux brûle instantanément avec explosion doux. Par conséquent, un tube à jet fin doit être utilisé pour voir la combustion de l'hydrogène.
- Gérer les acides et alcalis soigneusement.
Matériaux nécessaires:
Lab Procédure:
Observation:
- Par addition de sulfate de sodium au chlorure de baryum, un précipité blanc se forme immédiatement qui est insoluble dans dil.HCl.
: inférences
- Le sulfate de sodium réagit chimiquement avec le chlorure de baryum sous forme de leur solution aqueuse pour former un précipité blanc de sulfate de baryum.
- Cette réaction est une modification chimique, les produits sont tout à fait différents des réactifs dans la composition chimique et les propriétés chimiques.
Simulateur de procédure:
Vous pouvez sélectionner les réactions en cliquant sur les icônes respectives.
La combustion de magnésium dans l'air
- Pour allumer le brûleur, cliquez sur le bouton du brûleur.
- Cliquez sur les pinces pour brûler le ruban de magnésium et déposer les cendres dans le plat en porcelaine.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Faites glisser la spatule et mettre un peu de cendres (MgO) dans les trois documents décisifs.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
Sublimation de glace carbonique
- Gardez quelques morceaux de glace sèche dans un bol.
- Vous pouvez voir qu'un gaz est formé à partir du bol.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
La réaction entre Sulfate de sodium (Na2 SO4 (aq)) et de chlorure de baryum (BaCl2 (aq))
La réaction de clous de fer avec une solution de sulfate de cuivre (CuSO4 (aq))
- Vous pouvez voir deux tubes à essai avec une solution de sulfate de cuivre et deux clous de fer nettoyés avec fil.
- Faire glisser un clou de fer en direction de l'un des tubes à essai à l'immerger dans une solution de sulfate de cuivre.
- Une fois que le fait, attendre jusqu'à ce que le chronomètre indique 15 minutes.
- Après environ 15 minutes, vous pouvez voir que la couleur de la solution passe du bleu au vert.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Cliquez sur le fil pour enlever l'ongle de fer du tube à essai.
- Vous pouvez voir un revêtement brun sur l'ongle de fer.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
Le chauffage de sulfate de cuivre (CuSO4)
- Pour allumer le brûleur, cliquez sur le bouton du brûleur.
- Pour chauffer le sulfate de cuivre hydraté, faire glisser le support de tube d'ébullition vers le brûleur.
- Le brûleur se désactive automatiquement lorsque les cristaux de sulpahte de cuivre de couleur bleu change de couleur au blanc.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Faire glisser la pipette vers le récipient de prélèvement d'eau distillée et le faire glisser en arrière vers le tube d'ébullition à ajouter de l'eau bouillante dans le tube contenant du sulfate de cuivre anhydre.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
- Prenez quelques cubes de glace dans un bol et le garder pendant un certain temps.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
La réaction du zinc avec l'acide sulfurique dilué
Vous pouvez sélectionner les tests d'identification en cliquant sur les icônes correspondantes ci-dessous.
- Pour ajouter des granules de zinc dans de l'acide sulfurique dilué, faire glisser la spatule vers le tube à essai.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Faites glisser les documents de tournesol, un par un sur la bouche du tube de test pour vérifier sa réaction avec le gaz sortant du tube à essai.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
- Faire glisser la spatule vers le tube à essai à ajouter des granules de zinc dans le tube d'essai contenant dil. H2 SO4.
- Pour fermer le tube d'essai, faites glisser le bouchon ennuyez unique dans lequel un tube à jet fin est inséré, vers le tube à essai.
- Faire glisser la bougie allumée vers l'embouchure du tube de jet fin.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
- Faire glisser la spatule vers le tube à essai à ajouter des granules de zinc dans le tube d'essai contenant dil. H2 SO4.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Attendez un peu de temps pour terminer la réaction.
- Faites glisser le compte-gouttes pour ajouter NaOH dans le tube à essai contenant une solution de sulfate de zinc.
- Cliquez sur le tube de test pour bien agiter le contenu du tube à essai.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Encore une fois faites glisser le compte-gouttes pour ajouter un excès de NaOH dans le tube à essai.
- Cliquez sur le tube de test pour bien agiter le contenu du tube à essai.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
- Faire glisser la spatule vers le tube à essai à ajouter des granules de zinc dans le tube d'essai contenant dil. H2 SO4.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Attendez un peu de temps pour terminer la réaction.
- Pour passer du H2 gazeux à travers la solution de, faire glisser le tube à essai vers l'appareil du Kipp.
- Cliquer sur le bouton de l'appareil Kipps pour l'ouvrir et passer le gaz H2 à travers de la solution dans le tube à essai.
- Cliquez sur le bouton de l'appareil Kipps pour le fermer.
- Cliquez sur le tube de test pour bien agiter le contenu du tube à essai.
- Vous pouvez voir l'inférence en cliquant sur l'icône d'inférence.
- Vous pouvez vérifier votre résultat en cliquant sur les icônes affichées sur le côté droit.
- Cliquez sur le bouton « Reset » de refaire l'expérience.
Remarque: Cliquez sur le bouton « HELP » pour voir les instructions.
précautions:
- Utilisez les produits chimiques judicieusement.
- Gardez la bouche du tube d'essai de votre visage et aussi d'autres camarades de classe.
- Manipuler les acides et alcalins soigneusement.