Oxyacide, composé chimique
oxyacide, un acide contenant pas d'oxygène. La plupart des oxydes non métalliques covalents réagissent avec l'eau pour former des oxydes acides; autrement dit, ils réagissent avec l'eau pour former des oxyacides qui donnent des ions hydronium (H3 O +) en solution. Il y a quelques exceptions, comme le monoxyde de carbone. CO, l'oxyde nitreux. N2 O, et l'oxyde nitrique. NON.
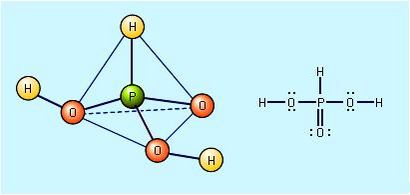
La structure de l'acide phosphoreux, H3 PO3.
Encyclopædia Britannica, Inc.
La force d'un oxyacide est définie par la mesure dans laquelle il se dissocie dans l'eau (à savoir sa capacité à former des ions H +). En général, la force relative des oxyacides peut être prédite sur la base de l'électronégativité et le nombre oxydation de l'atome non métallique central. La résistance à l'acide augmente à mesure que l'électronégativité de l'augmentation de l'atome central. Par exemple, parce que l'électronégativité du chlore (Cl) est supérieure à celle du soufre (S), qui est à son tour supérieure à celle du phosphore (P), on peut prévoir que l'acide perchlorique, HClO4. est un acide plus fort que l'acide sulfurique. H2 SO4. qui devrait être un acide plus fort que l'acide phosphorique. H3 PO4. Pour un atome non métallique central, la résistance à l'acide donné augmente à mesure que le nombre d'oxydation de l'augmentation de l'atome central. Par exemple, l'acide nitrique. HNO3. dans lequel l'atome d'azote (N) a un degré d'oxydation de +5, est un acide plus fort que l'acide nitreux. HNO2. où l'état d'oxydation de l'azote est 3. De la même manière, l'acide sulfurique, H2 SO4. avec du soufre à l'état d'oxydation +6, est un acide plus fort que l'acide sulfureux, H2 SO3. où un certain nombre d'oxydation +4 de soufre existe.
Le sel d'un oxyacide est un composé formé lorsque l'acide réagit avec une base. acide + base de sel → + eau. Ce type de réaction est appelée neutralisation, parce que la solution est neutre.