Solution - corps, utilisé, l'eau, le gaz, le carbone, l'oxygène, l'air, la cause
Une solution est un mélange homogène de deux ou plusieurs substances. Le terme signifie homogènes # X0022; le même tout au long # x0022. Par exemple, supposons que vous faites une solution de sucre dans l'eau. Si vous deviez prendre une goutte de la solution de sucre partout dans la solution, il serait toujours la même composition.
Terminologie
Un certain nombre de termes spécialisés sont utilisés pour parler de solutions. Le solvant dans une solution est la substance qui fait la dissolution. Le soluté est la substance qui est dissoute. Dans la solution de sucre décrits ci-dessus, l'eau est le solvant et le sucre est le soluté.
Bien que cette définition est propre, il ne fait pas toujours beaucoup de sens. Par exemple, on peut faire une solution de deux gaz. En fait, l'air qui nous entoure est une solution consistant en l'oxygène, l'azote, l'argon, le dioxyde de carbone et d'autres gaz. Dans ce cas, il est difficile de dire quel gaz # X0022; fait la dissolution # x0022; et lequel le gaz (ou les gaz) # X0022; est dissous # x0022.
Un autre procédé de définition de solvant et le soluté est-à-dire que le composant de la solution présente dans la plus grande quantité est le solvant tandis que les composants présents dans des quantités moindres sont soluté. Selon cette définition, l'azote est le solvant dans l'air atmosphérique, car il est présent dans la plus grande quantité. Oxygène, argon, dioxyde de carbone et d'autres gaz, sont alors les solutés.
Mots à connaitre
Concentration: La quantité d'une substance (soluté) présent dans un volume de solvant ou d'une solution donnée.
Homogène: La même chose partout.
Miscibilité: La mesure dans laquelle une substance se mélange avec une autre substance.
Saturé: En se référant aux solutions, une solution qui contient la quantité maximale de soluté pour une quantité donnée de solvant à une température donnée.
Solubilité: La tendance d'une substance à dissoudre dans une autre substance.
Solutés: La substance est # X0022; dissous # x0022; ou qui existe dans la moindre quantité d'une solution.
Solvant: La substance # X0022; fait la dissolution # x0022; ou qui existe dans la plus grande quantité dans une solution.
Sursaturé: En se référant aux solutions, une solution qui contient plus que la quantité maximale de solvant qui peuvent normalement être dissous dans une quantité donnée de solvant à une température donnée.
Insaturé: En se référant aux solutions, une solution qui contient moins que la quantité maximale de solvant qui peut être dissoute dans une quantité donnée de solvant à une température donnée.
La solubilité est un terme similaire à miscibilité mais plus précis. La solubilité d'une substance est la quantité de la substance qui se dissout dans une quantité donnée de solvant. Par exemple, la solubilité du sucre dans l'eau est d'environ 90 grammes de sucre par 100 g d'eau. Cette déclaration signifie que l'on peut dissoudre jusqu'à 90 grammes de sucre dans 100 grammes d'eau.
La solubilité d'une substance dépend de la température. La déclaration à l'alinéa précédent, par exemple, aurait été que 90 grammes de sucre se dissout dans 100 grammes d'eau à une température spécifique. Cette température se trouve être 0 # x00B0; C.
D'une manière générale, la solubilité des substances augmente avec la température. Le graphique de la Figure 1 illustre ce point. Notez que la solubilité du sucre augmente à un peu plus de 100 grammes pour 100 grammes d'eau à 25 # x00B0; C et 130 grammes pour 100 grammes d'eau à 50 # x00B0; C.
Une exception importante à cette règle concerne les gaz. Tous les gaz deviennent moins solubles dans l'eau que la température augmente.
Concentration des solutions
Les solutions sont des mélanges dont la composition peut varier considérablement. On peut faire une solution aqueuse de chlorure de sodium par dissolution de 1 g de chlorure de sodium dans 100 grammes d'eau; 5 grammes dans 100 grammes d'eau; 10 grammes dans 100 grammes d'eau; etc. La quantité de soluté pour toute quantité donnée de solvant est définie comme la concentration de la solution.
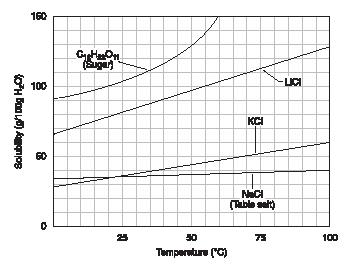
Figure 1. (Reproduit avec l'autorisation de
Une façon d'exprimer la concentration d'une solution est diluée avec les termes et concentré. Ces termes ne sont pas très spécifiques. Par exemple, une solution contenant 1 g de chlorure de sodium dans 100 grammes d'eau et une seconde solution contenant 2 g de chlorure de sodium dans 100 grammes d'eau sont à la fois dilué. Mais le terme est approprié parce que, à la température ambiante, près de 40 grammes de chlorure de sodium peut être dissous dans 100 grammes d'eau. Ainsi, une solution contenant 35 grammes de chlorure de sodium dans 100 grammes d'eau pourrait être appelée une solution concentrée.
Les solutions peuvent également être classés comme saturés, insaturés ou sursaturée. Une solution saturée est une qui contient tout le soluté son possible à une température donnée. Par exemple, la solubilité du chlorure de sodium dans l'eau est de 37 grammes pour 100 grammes d'eau. En cas d'une solution contenant 37 g de chlorure de sodium dans 100 grammes d'eau, la solution est dit saturé; il peut # x0027; t tenir plus du chlorure de sodium.
Toute solution contenant moins de la quantité maximale possible de soluté est dit être insaturé. Une solution de 5 g de chlorure de sodium (ou 10 g ou 20 g ou 30 g) dans 100 grammes d'eau est insaturé.
Enfin, les solutions sursaturées sont également possibles. Aussi bizarre que cela puisse paraître, une solution sursaturée est celui qui détient plus que soluté est possible à une température donnée. La façon de faire une solution sursaturée est de faire une solution saturée à une température plus élevée, puis laissez refroidir la solution très soigneusement.
Par exemple, on pourrait faire une solution saturée de sucre dans l'eau à 50 # x00B0; C en ajoutant 130 grammes de sucre pour 100 grammes d'eau. Cette solution serait saturée. Mais alors, on pourrait permettre à la solution refroidir très lentement. Dans ces circonstances, il peut arriver que tout le sucre resterait en solution, même à une température de 25 # x00B0; C. Mais à cette température, la solubilité du sucre est normalement un peu plus de 100 grammes pour 100 grammes d'eau. Par conséquent, la solution refroidie serait sursaturée. solutions sursaturées sont normalement très instable. Le moindre mouvement dans la solution, comme secouer simplement, peut causer l'excès soluté de régler de la solution.
Lisez également l'article sur la solution de Wikipedia