Étapes faciles pour l'équilibrage des équations chimiques
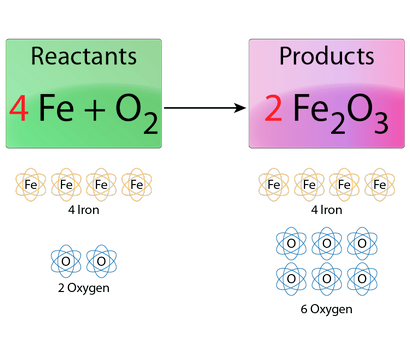
Ce produit chimique est équilibré pour les atomes de fer, mais pas pour des atomes d'oxygène. Le coefficient est en rouge. Todd Helmenstine
Lors de l'équilibrage des équations, vous ne changez jamais les indices. Vous ajoutez des coefficients. Coefficients multiplicateurs sont des nombres entiers. Si, par exemple, on écrit 2 H2 O, cela signifie que vous avez 2 fois le nombre d'atomes de carbone dans chaque molécule d'eau, ce qui serait de 4 atomes d'hydrogène et 2 atomes d'oxygène. Comme avec subscripts vous n'écrivez pas le coefficient de « 1 », donc si vous ne voyez pas un coefficient, cela signifie qu'il ya une molécule.
Il y a une stratégie qui vous aidera à équilibrer les équations plus rapidement. Il est appelé équilibre par l'inspection. Fondamentalement, vous regardez combien d'atomes que vous avez sur chaque côté de l'équation et ajouter des coefficients aux molécules pour équilibrer le nombre d'atomes.
- atomes d'équilibre présents dans une seule molécule de réactif et de produit en premier.
- Équilibrer les atomes d'oxygène ou d'hydrogène dernier.
Le fer est présent dans un réactif et un produit, de sorte à équilibrer ses atomes premier. Il y a un atome de fer à gauche et deux à droite, on pourrait croire mettre 2 Fe à gauche fonctionnerait. Bien que cela reste étant du fer, vous savez déjà que vous allez avoir à régler l'oxygène, aussi, parce que ce n'est pas équilibré. Par inspection (à savoir regarder), vous savez que vous devez jeter un coefficient de 2 pour un plus grand nombre.
3 Fe ne fonctionne pas sur la gauche parce que vous ne pouvez pas mettre un coefficient à partir de Fe2 O3 qui équilibre.
4 Fe fonctionne, si vous ajoutez ensuite un coefficient de 2 en face de la molécule de rouille (oxyde de fer), ce qui en fait 2 Fe2 O3. Cela vous donne:
Le fer est équilibré, avec 4 atomes de fer, de chaque côté de l'équation. Ensuite, vous avez besoin d'équilibrer l'oxygène.
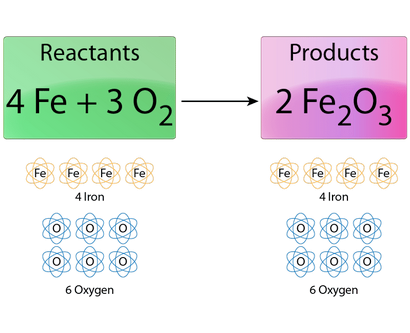
Ceci est l'équation équilibrée pour la rouille du fer. Notez qu'il est le même nombre d'atomes réactifs que des atomes de produits. Todd Helmenstine
Ceci est l'équation équilibrée pour le fer:
Lors de l'équilibrage des équations chimiques, la dernière étape consiste à ajouter des coefficients d'oxygène et des atomes d'hydrogène. La raison est parce qu'ils apparaissent généralement dans plusieurs réactifs et produits, donc si vous les abordez d'abord vous faites habituellement du travail supplémentaire pour vous-même.
Maintenant, regardez l'équation (inspection de l'utilisation) pour voir quel coefficient fonctionnera pour équilibrer l'oxygène. Si vous mettez un 2 à partir de O2. qui vous donnera 4 atomes d'oxygène, mais il faut 6 atomes d'oxygène dans le produit (coefficient de 2 multipliée par l'indice de 3). Donc, 2 ne fonctionne pas.
Si vous essayez 3 O2. alors vous avez 6 atomes d'oxygène sur le côté réactif et aussi 6 atomes d'oxygène sur le côté du produit. Cela marche! L'équation chimique équilibrée est:
Remarque: Vous auriez pu écrire une équation équilibrée en utilisant des multiples des coefficients. Par exemple, si vous doublez tous les coefficients, vous avez encore une équation équilibrée:
Cependant, les chimistes écrivent toujours l'équation la plus simple, afin de vérifier votre travail pour vous assurer que vous ne pouvez pas réduire vos coefficients.