Hypertonique injection Dextrose - FDA les informations de prescription, les effets secondaires et utilisations
Hypertonique injection Dextrose - pharmacologie clinique
Hypertonique Dextrose Injections, USP fournissent des calories et sont une source d'eau pour l'hydratation. Ces solutions sont capables d'induire la diurèse en fonction de l'état clinique du patient.
solutions de dextrose hypertonique fournissent une source maximum de calories dans un volume de fluide minimal.
Indications et utilisation pour hypertonique injection Dextrose
Ces solutions intraveineuses sont indiquées pour une utilisation chez les adultes et chez les enfants comme sources de calories et de l'eau pour l'hydratation.
Contre-indications
L'administration de solutions contenant du dextrose hypertonique est contre-indiqué chez les patients présentant une hémorragie intracrânienne ou intraspinale, le coma diabétique ou delirium tremens, en particulier si de tels patients sont déjà déshydraté.
L'administration de solutions intraveineuses peut provoquer une surcharge hydrique et / ou soluté résultant en une dilution des concentrations d'électrolytes sériques, hyperhydratation, encombré des états ou un oedème pulmonaire. Le risque d'états dilutional est inversement proportionnelle à la concentration d'électrolyte.
Les solutions contenant du dextrose sans électrolytes ne doivent pas être administrés simultanément avec du sang par le même ensemble de perfusion en raison de la possibilité d'agglomération.
précautions
Les solutions contenant le dextrose doit être utilisé avec prudence chez les patients avec diabète sucré ou d'intolérance glucidique ou manifeste connus du diabète subcliniques pour une raison quelconque.
électrolytes essentiels, des minéraux et des vitamines doivent être fournis au besoin.
Lorsque des perfusions de dextrose concentré sont interrompues, il est souhaitable de substituer une solution de 5% ou 10% de dextrose pour prévenir l'hypoglycémie de rebond.
Ces solutions sont destinées à l'administration intraveineuse en utilisant du matériel stérile. Il est recommandé que l'appareil d'administration intraveineuse soit remplacé au moins une fois toutes les 24 heures.
Ne pas utiliser si la solution est claire, la fermeture est intacte et le vide est présent.
Ces médicaments ne contiennent pas plus de 25 μ g / L d'aluminium.
Tests de laboratoire
Interactions médicamenteuses
Carcinogenesis, Mutagenesis, Affaiblissement de Fertilité
Des études avec hypertonique, USP Dextrose Injections n'a été réalisée pour évaluer le potentiel cancérogène, mutagène ou potentiel des effets sur la fertilité.
Catégorie de grossesse C
Les études de reproduction animale n'a été menée avec hypertonique, USP Dextrose Injections. On ne sait pas si hypertonique Dextrose Injections, USP peut nuire au fœtus lorsqu'il est administré à une femme enceinte ou peut affecter la capacité de reproduction. Hypertonique Dextrose Injections, USP doit être administré à une femme enceinte seulement si clairement nécessaire.
Travail et accouchement
Tel que rapporté dans la littérature, des solutions de dextrose ont été administrées pendant le travail et l'accouchement. Il faut être prudent, et l'équilibre de fluide, les concentrations de glucose et d'électrolytes et de l'équilibre acide-base, de la mère et le foetus doit être évaluée périodiquement ou chaque fois que justifiée par l'état du patient ou foetus.
Mères infirmières
Parce que de nombreux médicaments sont excrétés dans le lait maternel, il faut être prudent lorsque hypertonique, USP Dextrose Injections sont administrés aux femmes qui allaitent.
utilisation chez l'enfant
Les concentrations sériques de glucose doivent être surveillés fréquemment lorsque le dextrose est prescrit aux patients pédiatriques, en particulier les nourrissons, les nouveau-nés et les nourrissons de faible poids à la naissance.
utilisation gériatrique
Effets indésirables
Si une réaction indésirable ne se produit, arrêtez l'injection, évaluer le patient, l'Institut des contre-mesures thérapeutiques appropriées et sauver le reste du liquide pour l'examen si cela est jugé nécessaire.
Surdosage
En cas de surcharge liquidienne ou soluté pendant le traitement par voie parentérale, réévaluez l'état du patient et instituez le traitement correctif approprié.
Hypertonique injection Dextrose Dosage et administration
Ces solutions sont pour l'administration intraveineuse. Hypertonique, administrer uniquement après dilution par l'intermédiaire d'un cathéter veineux central.
La posologie doit être dirigé par un médecin et dépend de l'âge, le poids, l'état clinique des déterminations du patient et de laboratoire. des déterminations de laboratoire fréquentes et une évaluation clinique sont essentiels pour surveiller les changements dans le glucose sanguin et les concentrations d'électrolyte, et l'équilibre hydro-électrolytique pendant le traitement par voie parentérale prolongée.
L'administration liquide doit être basée sur les besoins d'entretien ou de remplacement des fluides calculés pour chaque patient.
produits pharmaceutiques parentéral doivent être inspectés visuellement pour les particules et la décoloration avant l'administration, chaque fois permis de solution et le récipient.
utilisation chez l'enfant
Il n'y a pas de dose pédiatrique spécifique. La dose dépend du poids, l'état clinique et les résultats de laboratoire. Suivez les recommandations du texte de référence pédiatriques appropriés. (Voir MISES EN GARDE et PRÉCAUTIONS.)
Comment est hypertonique injection Dextrose Fourni
Hypertoniques Injections de dextrose, USP sont fournis stérile et apyrogène dans remplissage complet et récipients en verre partiels de remplissage avec des bouchons solides. Les récipients sont emballés 1000 ml 6 par cas et les récipients de 500 ml sont emballés 12 par cas.
L'exposition des produits pharmaceutiques à la chaleur devrait être minimisée. Évitez la chaleur excessive. Protéger du gel. Il est recommandé que le produit être conservé à température ambiante (25 ° C / 77 ° F); Cependant, une brève exposition jusqu'à 40 ° C / 104 ° F n'a pas d'incidence négative sur le produit.
Mode d'emploi de B. Braun de contenants en verre avec Stoppers solides
Avant toute utilisation, effectuer les contrôles suivants:
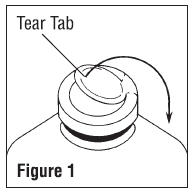
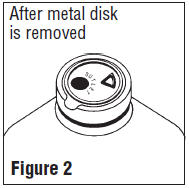
Attention: Pour les conteneurs de remplissage partiel (un litre et plus) ont un vide élevé pour faciliter les grandes additions ou des transferts. Cela crée un risque d'implosion et nécessite une attention particulière à l'utilisation et la manipulation.
Avis: Variation de couleur entre différents lots et entre les unités du même lot, est normal pour les solutions d'hydrates de carbone, et des solutions d'électrolytes contenant des sucres. Ces différences de couleur n'a aucun effet sur la valeur thérapeutique des solutions.
B. Braun Medical Inc.
Irvine, CA 92614-5895 USA
Fabriqué aux États-Unis
Au Canada, distribué par:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
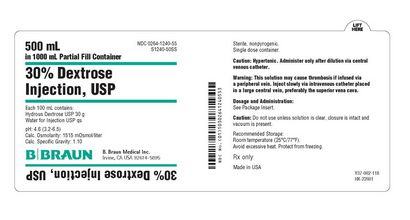
PANNEAU D'AFFICHAGE PRINCIPAL - 500 ml Étiquette Conteneur
500 ml
dans 1000 ml partiel conteneur de remplissage
NDC 0264-1240-55
S1240-50SS
30% Dextrose
Injection, USP
Chaque 100 ml contient:
Hydrous USP Dextrose 30 g
L'eau pour injection USP qs
pH 4,6 (03/02 à 06/05)
Calc. Osmolarité: 1515 mOsmol / litre
Calc. Densité: 1.10
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Stérile, apyrogène.
Récipient à dose unique.
Attention: hypertonique. Administrez seulement après dilution par le centre
un cathéter veineux.
Dosage et administration:
Voir Insérer Package.
Attention: Ne pas utiliser si la solution est claire, la fermeture est intacte et
le vide est présent.
Stockage recommandé:
La température ambiante (25 ° C / 77 ° F).
Évitez la chaleur excessive. Protéger du gel.
PANNEAU D'AFFICHAGE PRINCIPAL - 500 ml Étiquette Conteneur
500 ml
dans 1000 ml partiel conteneur de remplissage
NDC 0264-1280-50
S1280-50SS
50%
DEXTROSE
INJECTION, USP
Chaque 100 ml contient:
USP 50 Hydrous Dextrose g
L'eau pour injection USP qs
pH: 4,6 (03/02 à 06/05)
Calc. Osmolarité: 2525 mOsmol / litre
Calc. Densité: 1,17
B. Braun Medical Inc.
Irvine, CA 92614-5895 USA
Stérile, apyrogène. Récipient à dose unique.
Attention: hypertonique. Administrez seulement après dilution par
un cathéter veineux central.
Dosage et administration:
Voir Insérer Package.
Attention: Ne pas utiliser si la solution est claire, la fermeture est intacte
et le vide est présent.
Stockage recommandé:
La température ambiante (25 ° C / 77 ° F). Évitez la chaleur excessive.
Protéger du gel.
Fabriqué aux États-Unis
HK-22602
Y37-002-261 LD-290-1

PANNEAU D'AFFICHAGE PRINCIPAL - 1000 ml Étiquette Conteneur
Canada DIN 01924273
NDC 0264-1280-55
S1280-SS
50%
DEXTROSE
INJECTION, USP
NE PAS DIRECT INFUSION DOIT ÊTRE DILUÉ
Chaque 100 ml contient:
USP 50 Hydrous Dextrose g
L'eau pour injection USP qs
pH: 4,6 (03/02 à 06/05), hypertonique
Calc. Osmolarité: 2525 mOsmol / litre
Calc. Densité: 1,17
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Stérile, apyrogène.
Récipient à dose unique.
Dosage et administration:
Voir Insérer Package.
Attention: Ne pas utiliser si la solution est claire, la fermeture est intacte
et le vide est présent.
Stockage recommandé:
La température ambiante (25 ° C / 77 ° F).
Évitez la chaleur excessive. Protéger du gel.
Au Canada, distribué par:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
Fabriqué aux États-Unis
Y37-002-124
HK-22602

PANNEAU D'AFFICHAGE PRINCIPAL - 500 ml Étiquette Conteneur
500 ml
dans 1000 ml partiel conteneur de remplissage
Canada DIN 01924265
NDC 0264-1290-50
S1290-50SS
DEXTROSE
INJECTION, USP
70%
Chaque 100 ml contient:
Hydrous USP Dextrose 70 g
L'eau pour injection USP qs
pH 4,6 (03/02 à 06/05)
Calc. Osmolarité: 3530 mOsmol / litre
Calc. Densité: 1,23
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Stérile, apyrogène. Récipient à dose unique.
Attention: hypertonique. Administrez seulement après dilution par le centre
un cathéter veineux.
Dosage et administration:
Voir Insérer Package.
Attention: Ne pas utiliser si la solution est claire, la fermeture est intacte et
le vide est présent.
Stockage recommandé:
La température ambiante (25 ° C / 77 ° F).
Évitez la chaleur excessive. Protéger du gel.
Au Canada, distribué par:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
Y37-002-127 (HK-22603)
Fabriqué aux États-Unis
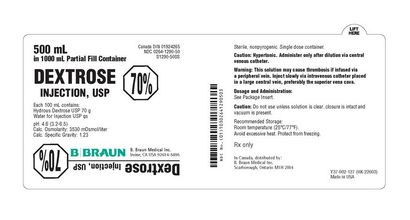
PANNEAU D'AFFICHAGE PRINCIPAL - 1000 ml Étiquette Conteneur
NDC 0264-1290-55
S1290-SS
INJECTION DEXTROSE, USP
70%
NE PAS DIRECT INFUSION
DOIT ÊTRE DILUÉ
Chaque 100 ml contient:
Hydrous USP Dextrose 70 g
L'eau pour injection USP qs
pH: 4,6 (03/02 à 06/05), hypertonique
Calc. Osmolarité: 3530 mOsmol / litre
Calc. Densité: 1,23
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Stérile, apyrogène.
Récipient à dose unique.
Dosage et administration:
Voir Insérer Package.
Attention: Ne pas utiliser si la solution est claire, la fermeture est intacte
et le vide est présent.
Stockage recommandé:
La température ambiante (25 ° C / 77 ° F). Évitez la chaleur excessive.
Protéger du gel.
Fabriqué aux États-Unis
Y37-002-128
HK-22603
