Inorganique Chimie industrielle - Encyclopédie Chimie - réaction, l'eau, les utilisations, les exemples, le gaz,
chimie inorganique industrielle comprend des subdivisions de l'industrie chimique qui fabriquent des produits inorganiques sur une grande échelle tels que les composés inorganiques lourds (chlorures alcalins, l'acide sulfurique, des sulfates) et les engrais (potassium, d'azote et de produits de phosphore) ainsi que les segments de la chimie fine qui sont utilisés pour produire des composés inorganiques de grande pureté à une échelle beaucoup plus petite. Parmi ceux-ci sont des réactifs et des matières premières utilisées dans les industries de haute technologie, des produits pharmaceutiques ou des appareils électroniques, par exemple, ainsi que dans la préparation de spécialités inorganiques tels que des catalyseurs, des pigments et des agents propulseurs.
Les métaux sont des produits chimiques dans un certain sens. Ils sont fabriqués à partir de minerais et purifiés par un grand nombre des mêmes processus que ceux utilisés dans la fabrication de matières inorganiques. Toutefois, si elles sont commercialisées sous forme d'alliages ou sous forme pure comme le fer, le plomb, le cuivre ou le tungstène, ils sont considérés comme des produits de l'industrie chimique non métallurgique.
L'industrie chimique
Produits chimiques de base représentent le point de départ pour la fabrication de produits chimiques industriels inorganiques. Ils sont généralement une étape des matières premières énumérées dans le tableau 1 et sont produits sur une très grande échelle en utilisant des processus continus. Le prix unitaire de ces produits est relativement faible, et les produire à bon marché et efficace est une préoccupation majeure pour les entreprises qui les fabriquent. industries de soufre, d'azote, de phosphore et sont les principaux chloralcali producteurs de produits chimiques inorganiques de base, et ils les vendent souvent à d'autres industries, ainsi que leur utilisation dans la fabrication de leurs propres produits finis. Les principes de base pour leur production et les principales utilisations sont indiquées ici pour chacune de ces industries.
Produits chimiques inorganiques produits à l'échelle industrielle peuvent être facilement identifiés. Beaucoup d'entre aujourd'hui # x0027; de grandes entreprises ont commencé en tant que producteurs de matières inorganiques,

Produits chimiques inorganiques tels que le chlore, produit à cette plante en Louisiane, sont utilisés dans la fabrication de plusieurs chlorures, y compris l'acide chlorhydrique du PVC et.
Sources de matières premières inorganiques
Il existe de nombreuses sources de matières premières pour la fabrication de produits chimiques inorganiques (voir le tableau 1). Très peu d'entre eux se trouvent dans leur forme élémentaire. Le soufre est une exception notable. Il se produit dans des gisements souterrains et peut être amené à la surface par de l'air comprimé après avoir été fondu par la vapeur surchauffée. Cependant, des quantités croissantes de soufre sont récupérés à partir du pétrole et du gaz naturel (où ils se produisent sous forme d'impuretés).
Récupération et recyclage fournissent des quantités croissantes de certains métaux. En ce qui concerne l'environnement augmentent, ces opérations vont probablement devenir une source importante de matériaux utilisés dans la fabrication de certains produits chimiques inorganiques.
de la soude caustique, les formulations de nettoyage
Les débuts de l'industrie chimique
Les origines de l'industrie chimique remontent à la révolution industrielle. l'acide sulfurique et du carbonate de sodium ont été parmi les premiers produits chimiques industriels. # X0022; huile de vitriol # X0022; (Comme l'ancien était connu) a joué un rôle important dans la manipulation des métaux, mais sa production à l'échelle industrielle nécessaire au développement des matériaux qui résistent aux attaques. Le carbonate de sodium a été obtenu sous sa forme anhydre, # X0022; carbonate de sodium, # x0022; de matières végétales jusqu'à ce que les quantités produites ne pouvait plus répondre aux besoins en rapide expansion des fabricants de verre, du savon et des textiles. Cela a conduit l'Académie Royale des Sciences de Paris, en 1775, pour établir un concours pour la découverte d'un procédé à base d'une matière première abondante, le chlorure de sodium, et Nicolas Leblanc # x0027; méthode s pour la préparation de soude en convertissant le sel en sulfate
suivie de la conversion du sulfate de soude avec du charbon et de la craie
Bien qu'il n'a pas gagné le prix, Leblanc # x0027; processus de est associé à la naissance de la chimie industrielle.
La production industrielle de produits chimiques est généralement basée sur l'exécution des réactions qui ont été connus pour obtenir les produits désirés sur des échelles beaucoup plus grandes. Le succès de ces efforts était beaucoup plus dans l'expérience et la compétence de leurs praticiens que l'application des principes chimiques solides. Cela a conduit à de graves problèmes de contrôle et la production de sous-produits nocifs. L'introduction du processus Leblanc dans le nord-ouest de l'Angleterre a conduit à un tollé public général contre la fumée noire et corrosif qui a couvert la campagne environnante. La Loi Alkali, adoptée en réponse en 1863, représente la première loi qui a établi des normes d'émission.
L'acide sulfurique est un produit chimique essentiel pour teinturiers, blanchisseurs et les fabricants alcalins. Sa production à grande échelle a nécessité le développement des chambres plombées qui pourraient résister aux vapeurs qui se forme lorsque le soufre a été brûlé avec des nitrates
L'acide sulfurique a également été utilisé dans la fabrication de superphosphates, qui ont été produits comme engrais à grande échelle par le milieu du XIXe siècle. En ce moment-là, une solution a été trouvée pour les problèmes techniques complexes qui ont entravé l'utilisation du procédé alternatif pour produire de la soude
Ernest Solvay, chimiste belge, a conçu une tour dans laquelle le dioxyde de carbone mis à réagir de manière efficace avec les sels solides. Le procédé Solvay a d'énormes avantages par rapport au processus Leblanc: Il n'a pas généré autant de déchets et de la pollution; ses matières premières, de la saumure et de l'ammoniac, sont facilement disponibles (ce dernier à partir de gasworks); moins de carburant a été utilisé, et pas de soufre ou le nitrate a été impliqué. Malgré ses coûts en capital plus élevés, il a été rapidement adopté et est rapidement devenu la principale source d'alcali.
L'acide sulfurique et les sulfates
L'acide sulfurique a longtemps été le produit chimique qui est fabriqué dans les plus grandes quantités à l'échelle mondiale (voir le tableau 2). Sa production est souvent liée à un pays # x0027; s stade de développement, en raison du grand nombre de processus de transformation dans lequel il est utilisé.
L'acide sulfurique est fabriqué à partir de soufre élémentaire. Mining était la source principale pour cet élément, qui a été obtenu à partir de minerais contenant du sulfure, ou sous une forme très pure à partir de gisements souterrains par le procédé Frasch (injection de vapeur surchauffée et d'air dans des perçages et la séparation du mélange qui monte à la surface ). La consommation à grande échelle du pétrole et du gaz naturel a changé ce scénario puisque le soufre se produit comme une impureté dans la plupart des combustibles fossiles et doivent être enlevés avant sont traités les carburants. Ces carburants sont actuellement la principale source de soufre, et leur importance relative a tendance à augmenter avec des contrôles plus rigoureux sur les émissions.
L'acide sulfurique est fabriquée en trois étapes
Etant donné que la réaction du soufre avec de l'air sec est exothermique, le dioxyde de soufre doit être refroidi pour éliminer l'excès de chaleur et éviter l'inversion de la réaction.
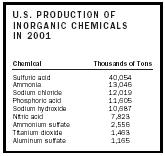
Comme une source peu coûteuse de l'acide, une grande quantité d'acide sulfurique qui est produit est utilisé pour la fabrication d'autres acides minéraux. Il est également utilisé pour produire des sulfates tels que le sulfate d'ammonium (un engrais à faible teneur), le sulfate de sodium (utilisé dans la production de papier), et le sulfate d'aluminium (utilisé dans le traitement de l'eau), ainsi que des sulfates organiques (utilisés comme agents tensio-actifs ). L'acide sulfurique est également un bon catalyseur pour de nombreuses réactions, y compris la transformation de l'éthanol dans de l'éther d'éthylène ou éthyle.
Les composés azotés
En général, les produits chimiques contenant de l'azote sont fabriqués à partir d'ammoniac produit par le procédé Haber
La consommation d'énergie est très élevé, et son coût est un élément important, ainsi que les matières premières. L'azote est facilement obtenu à partir de l'air, et de l'hydrogène et peut être produit par la réaction de déplacement
ou à partir de reformage d'hydrocarbures
D'autres étapes sont nécessaires pour assurer la conversion et pour supprimer le dioxyde de carbone ou du monoxyde de carbone du mélange de gaz. Un mélange d'ammoniac et de gaz de synthèse (CO + H 2) résulte de la réaction avec de l'azote afin que les deux doivent être séparés et le gaz de synthèse recyclé.
La plupart de l'ammoniac qui est produit est utilisé comme engrais ou utilisés pour fabriquer d'autres engrais, tels que l'urée, le sulfate d'ammonium, le nitrate d'ammonium ou le phosphate d'hydrogène de diammonium. L'ammoniac est également utilisé dans le procédé Solvay, et il est un matériau de départ pour la fabrication des cyanures et des nitriles (qui sont utilisés pour fabriquer des polymères tels que le nylon et l'acrylique), ainsi que des composés aromatiques contenant de l'azote, tels que la pyridine et l'aniline.
L'autre source de composés azotés dans l'industrie chimique est l'acide nitrique, obtenu à partir de l'oxydation de l'ammoniac
4 NH 3 + 5 O 2 # X2192; 4 NO + 6 H 2 O
La première réaction est effectuée sur des catalyseurs de platine-rhodium à environ 900 # x00B0; C (1652 # x00B0; F). Dans les deuxième et troisième étapes, un mélange d'oxyde nitrique et de l'air circule à travers les condenseurs, où il est partiellement oxydé. Le dioxyde d'azote est absorbé dans une tour, et enfonce l'acide nitrique vers le bas. L'acide nitrique est principalement utilisé pour faire le nitrate d'ammonium, la plus grande partie des engrais bien qu'il aille aussi dans la fabrication d'explosifs. Nitration est utilisé pour fabriquer des explosifs tels que la nitroglycérine et de trinitrotoluène (TNT) ainsi que de nombreux intermédiaires chimiques importants utilisés dans les industries pharmaceutiques et tinctoriales.
Les composés phosphorés
Le monde # x0027; de principale source de phosphore est apatite, une classe de minéraux de phosphate. Dans le commerce, le plus important est la fluoroapatite, un phosphate de calcium contenant du fluor. Ce fluor doit être enlevé pour la fabrication de l'acide phosphorique, mais il peut également être utilisé pour produire de l'acide fluorhydrique et de composés fluorés.
L'acide phosphorique est la matière de départ pour la plupart des phosphates qui sont produits industriellement. Il est obtenu à partir de la réaction du minéral apatite avec de l'acide sulfurique
La silice est présente dans la matière minérale sous forme d'impureté, et il réagit avec l'acide fluorhydrique pour produire le tétrafluorure de silicium, qui peut être converti en acide fluorosilicique, une source importante de fluor. Plus de la moitié de l'acide phosphorique qui est produit par la réaction de phosphates avec de l'acide sulfurique est converti directement en les phosphates de sodium ou d'ammonium pour être utilisé comme engrais; ainsi, la pureté est pas une préoccupation.
La concentration de l'acide phosphorique conduit à l'acide polyphosphorique, un mélange de plusieurs espèces polymères, un bon catalyseur et d'agent déshydratant. les sels polyphosphates sont utilisés comme adoucisseurs d'eau dans les détergents ou comme tampons dans les aliments. De petites quantités de phosphore élémentaire sont utilisés pour faire des matches et des halogénures de phosphore pour préparer des produits chimiques de spécialité pour les industries pharmaceutiques et agrochimiques.
Fabriques de chlore Composés
2 NaCl + 2 H 2 O # X2192; 2 NaOH + Cl 2 + H 2
Son utilisation principale est dans la fabrication d'acier, mais il va aussi dans la fabrication de produits chimiques, traitement de l'eau, et le contrôle de la pollution. Dans le procédé Solvay, le carbonate de calcium et le chlorure de sodium sont utilisées pour produire du chlorure de calcium et de carbonate de sodium avec de l'ammoniac (que l'on recycle) en tant que milieu pour la dissolution et la carbonatation du chlorure de sodium et l'hydroxyde de calcium pour précipiter le chlorure de calcium de la solution.
2 Br # X2212; + Cl 2 # X2192; Br 2 + 2Cl # X2212;
Le brome est utilisé pour la désinfection de l'eau; fibres de blanchiment et de soie; et dans la fabrication de composés de brome médicaments et les matières colorantes.
Le dioxyde de titane
Le dioxyde de titane est de loin le plus important composé de titane. Il peut être purifié par dissolution dans de l'acide sulfurique et précipitation des impuretés. La solution est ensuite hydrolysée, lavé et calciné. En variante, le rutile de masse est chloré en présence de carbone et le tétrachlorure de titane résultant est brûlé dans l'oxygène pour produire du chlorure.
Le dioxyde de titane se trouve dans la nature sous trois formes cristallines: Anastase, brookite et rutile. Son extrême blancheur et luminosité et son haut indice de réfraction sont responsables de son utilisation répandue comme pigment blanc dans les peintures, les laques, papier, revêtement de sol, les plastiques, les caoutchoucs, les textiles, la céramique et les cosmétiques.
Peter Rudolf Seidl
Carlos Eduardo da Silva Cortes