JWH-073 comment faire
Abstrait
Une méthode de chromatographie liquide a été développé pour résoudre un ensemble complet de métabolites de JWH-018 et JWH-073. En plus de la méthode d'analyse chromatographique, un procédé d'extraction a été mis au point pour récupérer une grande variété de métabolites cannabinoïdes synthétiques, y compris les métabolites d'acides carboxyliques qui ne sont pas traditionnellement récupérés à l'aide d'un pH élevé extraction liquide / liquide. Les méthodes d'extraction et d'analyse ont été utilisés pour identifier et quantifier les métabolites importants dans plusieurs échantillons d'urine authentiques. En plus de l'identification des métabolites connus, deux métabolites précédemment non déclarés ont été détectés.
Sur la base des données présentées ici, cette méthode convient pour la quantification des métabolites de JWH-018 et JWH-073 pour soutenir des études de recherche plus larges qui permettent d'identifier positivement métabolites cliniquement significatifs et leurs concentrations dans les urines.
En raison de la programmation des JWH-018 et JWH-073, les laboratoires sont maintenant chargés de développer des méthodes pour analyser l'urine pour les cannabinoïdes synthétiques. La recherche a montré que les composés de base sont largement métabolisé avant l'excrétion et, par conséquent, sont présents à des niveaux très faibles dans les échantillons d'urine [1]. Les métabolites les plus abondants sont meilleures cibles pour les tests de dépistage; Toutefois, étant donné l'utilisation illicite des cannabinoïdes synthétiques est relativement récente, a terminé la recherche limitée pour déterminer les profils exacts de métabolites.
Dans des travaux antérieurs, plusieurs métabolites de JWH-018 et JWH-073 ont été identifiés à l'aide à la fois in vivo et in vitro des études. Les métabolites identifiés comprennent les métabolites hydroxylés mono- et di, ainsi que des métabolites carboxylés [1,2]. Les métabolites hydroxylés et carboxylés sont généralement extraits séparément en raison de différences dans les valeurs de pKa pour ces composés. Les deux groupes de métabolites présentent certains défis chromatographiques; les analytes hydroxylés existent sous forme de plusieurs isomères de position qui sont impossibles à distinguer par MS / MS, et les composés carboxylés sont hydrophiles, ce qui les rend difficiles à maintenir en utilisant une RP-HPLC.
Le but de ce travail était de développer un procédé d'extraction et d'analyse adapté pour l'identification et la quantification d'un large éventail de métabolites de cannabinoïdes synthétiques connus et inconnus dans l'urine. Notre objectif était d'établir une méthodologie que l'extraction simplifiée et fourni résolution chromatographique fiable des métabolites cliniquement pertinents.
Expérimental
La conception expérimentale ensemble calibrateurs inclus préparés dans l'urine à 7 niveaux (1, 10, 25, 50, 100, 250 et 500 ng / ml), les flans de 6 sources séparées (3 mâles, 3 femelles), 2 de contrôle de qualité (QC ) des échantillons enrichis à 40 ng / ml, et 6 échantillons authentiques obtenus légalement. Quantification et validation partielle a été réalisée en utilisant cet ensemble d'échantillons. efficacité de l'extraction a été déterminée par la fortification d'une ébauche de post-extraction à 10 ng / mL et en comparant la surface du pic résultant de l'étalon correspondant, qui a été enrichi avant l'extraction.
La préparation des échantillons
Des échantillons d'urine ont été enrichis avec des métabolites cannabinoïdes synthétiques au calibrateur et les niveaux QC définis ci-dessus. concentration standard interne était de 40 ng / ml dans les urines pour tous les échantillons, à l'exception de la double vide.
échantillons enrichis et vierges ont été hydrolyses par addition de 1 ml d'échantillon de 1 mL de la bêta-glucuronidase de patelle (cat Sigma-Aldrich. # G8132 de) et en incubant à 60 ° C pendant 3 heures. La solution de bêta-glucuronidase a été préparé à 5000 unités Fishman / ml dans un tampon 100 mM d'acétate d'ammonium (pH = 5,0).
les échantillons hydrolyses ont ensuite été extraits en utilisant 6 ml, 500 mg C18 à charge élevée à terminaison Resprep ® cartouches SPE (cat. # 24052) selon le mode opératoire suivant. Notez que la cartouche ne doit pas être autorisé à aller à sec jusqu'à l'étape 6.
1. Ajouter 1 ml de 5 mM d'acétate d'ammonium dans 0,1% d'acide acétique (pH = 4,2) à l'échantillon hydrolysé.
2. Cartouche Condition avec 3 rinçages de 1 ml d'acétonitrile.
3. Cartouche d'état avec 3 rinçages de 1 mL 5 mM d'acétate d'ammonium à 0,1% d'acide acétique.
4. Appliquer l'échantillon à la cartouche et lui permettre de passer sous la gravité.
5. Cartouche de rinçage avec 3 portions de 1 ml de 5 mM d'acétate d'ammonium à 0,1% d'acide acétique.
6. Cartouche à sec sous vide pendant 10 minutes.
7. Eluer avec 3 ml d'acétonitrile, suivi par 3 ml de chlorure de butyle. Notez que l'utilisation de chlorure de butyle n'est pas nécessaire d'obtenir des recouvrements adéquats. Cependant, si elle est utilisée, ajouter le premier ml de chlorure de butyle au dernier ml d'acétonitrile pour que les solvants sont mélangés.
des extraits d'échantillons ont été évaporés à sec sous azote à 40 ° C et ensuite reconstituée dans 0,5 ml de (50:50) à 0,05% d'acide acétique dans de l'eau: 0,05% d'acide acétique dans de l'acétonitrile.
Une analyse
L'appareil utilisé pour cette analyse était un chromatographe liquide Shimadzu UFLC XR couplée à une API AB SCIEX 4000 Détecteur LC / MS / MS. conditions de l'instrument sont énumérés ci-dessous, et les transitions de MRM sont présentés dans le tableau I. Notez que la plupart des analytes inclus partagent ici des transitions communes. Au cours de l'optimisation des composés, les transitions ont été choisies en fonction de l'abondance, ainsi que le caractère unique, lorsque cela est possible.
La quantification a été réalisée en utilisant les normes internes comme spécifié dans le tableau I. Le choix de l'étalon interne pour la quantification était basée à la fois sur le temps d'identification et de rétention du composé (par exemple, JWH-073 4-hydroxybutyle a été quantifiée en utilisant JWH-018 acide-d4 pentanoïque plutôt que JWH -073 4-hydroxyindole-d7 en raison du fait que son temps de rétention a été très tôt par rapport à la JWH-073 4-hydroxyindole-d7 standard interne).
Conditions LC
Instrument: Shimadzu UFLC XR
Colonne: 5 um Ultra biphényle 50 mm x 2,1 mm (. Cat # 9109552)
Température de la colonne: 25 ° C
Phase Mobile: 0,05% d'acide acétique dans de l'eau (pH environ 3,4).
Phase mobile B: 0,05% d'acide acétique dans de l'acétonitrile
Volume d'injection: 10 ul
Débit: 0,5 ml / min.
MS / MS Conditions
Instrument: API 4000 MS / MS
Ionisation Mode: ESI +
Acquisition de données Type: MRM (non prévue)
Pulvérisation ionique Tension: 3,000V
Température Source: 600 ° C
Gaz rideau: 40 psi (275,8 kPa)
Gaz 1: 40 psi (275,8 kPa)
Gas 2: 40 psi (275,8 kPa)
CAD gaz: 4 psi (27,6 kPa)
Tableau I. transitions MRM et des normes internes utilisées pour la quantification.
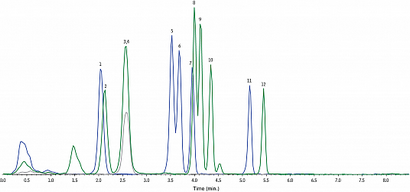
Figure 2: 1 ng / mL étalon.
JWH-073 acide N-butanoïque
JWH-018 acide N-pentanoïque
Ultra biphényle (cat. # 9109552)
50 mm x 2,1 mm ID
50:50 phase mobile
1 ng / mL extrait échantillon enrichi
eau + 0,05% d'acide acétique (pH env. 3,4)
acétonitrile + 0,05% d'acide acétique
Pulvérisation ionique Tension:
40 psi (275,8 kPa)
40 psi (275,8 kPa)
40 psi (275,8 kPa)
Depuis plusieurs transitions sont partagées entre les analytes, seulement 3 transitions sont représentées pour simplifier la visualisation. Les transitions sont représentées: 344,1 / 155,1 (trace bleue), 358,1 / 155,1 (trace verte), 372,1 / 155,2 (trace grise). Pour montrer à analytes pleine échelle, les normes internes ne sont pas représentés.
CAD gaz a été fixé à 4 livres par pouce carré.
50 ng / mL niveau d'étalonnage, voir chromatogramme LC_CF0531.
Pour 500 ng / mL niveau d'étalonnage, voir chromatogramme LC_CF0532.
L'échantillon a été préparé selon la méthode suivante:
1) De Spike 1 mL échantillon d'urine à blanc avec des analytes et des normes internes.
2) Hydrolyser échantillon:
- Ajouter 1 mL de solution de bêta-glucuronidase de patelle (cat Sigma-Aldrich. # G8132). Solution est préparée à une concentration de 5000 unités Fishman / ml dans un tampon de 100 mM d'acétate d'ammonium (pH = 5,0).
- Incuber à 60 ° C pendant 3 heures.
3) Extrait échantillon sur 6 ml, 500 mg C18 haute charge postsilanisée Resprep ® cartouche SPE (cat # 24052).:
- Ajouter 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique (pH = 4,2) à l'échantillon.
- Cartouche d'état avec 3 x 1 ml d'acétonitrile.
- Cartouche d'état avec 3 x 1 ml d'acétate d'ammonium 5 mM + 0,1% d'acide acétique.
- Appliquer l'échantillon et laisser passer par gravité.
- Rincer avec 3 x 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique.
- Cartouche à sec sous vide pendant 10 minutes.
- Éluer avec 3 ml d'acétonitrile suivi par 3 ml de chlorure de butyle.
4) Extrait concentré:
- Evaporer échantillon à sec sous azote à 40 ° C.
- Reconstituer dans 0,5 ml d'eau + 0,05% d'acide acétique: acétonitrile + 0,05% d'acide acétique (50:50).
Remerciements spéciaux à Cayman Chemical pour les normes de référence
Depuis plusieurs transitions sont partagées entre les analytes, seulement 5 transitions sont représentées pour simplifier la visualisation. Les transitions indiquées sont: 344,1 / 155,1 (trace bleue), 358,1 / 155,1 (trace verte), 372,1 / 155,2 (trace grise), 376,1 / 155,2 (trace pourpre - étalon interne), 351,3 / 127,0 (trace rouge - étalon interne)
CAD gaz a été fixé à 4 livres par pouce carré.
Pour 1 ng / mL niveau d'étalonnage, voir chromatogramme LC_CF0530.
50 ng / mL niveau d'étalonnage, voir chromatogramme LC_CF0531.
L'échantillon a été préparé selon la méthode suivante:
1) De Spike 1 mL échantillon d'urine à blanc avec des analytes et des normes internes.
2) Hydrolyser échantillon:
- Ajouter 1 mL de solution de bêta-glucuronidase de patelle (cat Sigma-Aldrich. # G8132). Solution est préparée à une concentration de 5000 unités Fishman / ml dans un tampon de 100 mM d'acétate d'ammonium (pH = 5,0).
- Incuber à 60 ° C pendant 3 heures.
3) Extrait échantillon sur 6 ml, 500 mg C18 haute charge postsilanisée Resprep ® cartouche SPE (cat # 24052).:
- Ajouter 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique (pH = 4,2) à l'échantillon.
- Cartouche d'état avec 3 x 1 ml d'acétonitrile.
- Cartouche d'état avec 3 x 1 ml d'acétate d'ammonium 5 mM + 0,1% d'acide acétique.
- Appliquer l'échantillon et laisser passer par gravité.
- Rincer avec 3 x 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique.
- Cartouche à sec sous vide pendant 10 minutes.
- Éluer avec 3 ml d'acétonitrile suivi par 3 ml de chlorure de butyle.
4) Extrait concentré:
- Evaporer échantillon à sec sous azote à 40 ° C.
- Reconstituer dans 0,5 ml d'eau + 0,05% d'acide acétique: acétonitrile + 0,05% d'acide acétique (50:50).
Remerciements spéciaux à Cayman Chemical pour les normes de référence
Les données de validation partielle
La performance du procédé chromatographique a été évaluée sur la base de signal sur bruit, linéarité, la précision de retour calculée pour calibrateurs, et la mesure de suppression d'ions (tableau II). Adéquates réponses de bas niveau ont été obtenus et une bonne linéarité (r ≥ 0,9982) a été observée pour tous les métabolites sur une plage quantitative de 1 ng / ml à 500 ng / ml dans les urines. Comparaison des concentrations d'étalonnage en arrière-calculées à des valeurs préparées a montré la précision a été obtenue aux deux extrémités de la plage linéaire pour tous les composés.
suppression d'ions a été déterminée par comparaison de région de crête d'un échantillon blanc enrichi après l'extraction à un niveau de solvant. Sur la base des résultats recueillis dans ce projet, aucune suppression n'a été observée, mais une amélioration significative a eu lieu pour plusieurs analytes.
Interférences et report ont également été évalués dans cette étude. Un échantillon a été injecté à double vide immédiatement après le haut calibrateur et aucun pic de report ou interférence n'a été observée avec des surfaces supérieures à 5% de la faible calibrateur. En outre, 5 autres échantillons vierges provenant de sources indépendantes ont été analysées et aucune interférence n'a été détectée dans aucun de ces échantillons.
Tableau II. les résultats de performance chromatographiques.
Linéarité (r)
(Pos. Ion)
Rétrocalculées
Précision
1 ng / ml **
* Rapport signal-à-bruit pour toutes les transitions de MRM à la limite de quantification était supérieur à 10: 1.
** précision Signalé, basée sur l'ion de quantification, était de 77,9% -119% pour tous les calibreurs et toutes les transitions.
Bien que des recouvrements pour certains composés étaient relativement faibles, l'utilisation d'une extraction à mi-pH (pH = 4,2) par opposition à une extraction à pH élevé autorisé pour la récupération des métabolites de l'acide carboxylique ainsi que les metabolites mono-hydroxy. Recouvrements des métabolites cliniquement significatifs ont varié de 70% à 78%. les méthodes déjà publiées décrivent l'utilisation d'une extraction liquide / liquide de pH élevé pour l'analyse des métabolites cannabinoïdes synthétiques [1]. Bien que la méthode d'extraction utilisée par Sobolevsky et al. est adapté pour métabolites hydroxylés, les taux de récupération des métabolites carboxylés sont très faibles à un pH élevé. Tandis qu'une seconde extraction liquide / liquide à un pH faible est nécessaire pour récupérer correctement les métabolites carboxylés, le procédé d'extraction de SPE développé pour cette analyse est adapté pour les metabolites mono-hydroxylés et carboxylés de JWH-018 et JWH-073.
Tableau III. résultats de la performance d'extraction.
Moy. Précision
40 ng / ml de QC
(N = 2) *
Récupération d'extraction
(QUANT Ion)
10 ng / mL
* La précision déclarée pour l'ion de quantification.
Analyse des échantillons authentiques
Après validation, 6 échantillons authentiques ont été préparés et analysés selon la méthode établie ici (tableau IV). Toutes les valeurs rapportées sont réunis ions critère de rapport pour le premier qualificatif transition MRM; Cependant, la plupart des résultats pour JWH-018 5 hydroxypentyle ne répondaient pas aux critères de rapport d'ions pour la deuxième qualification. Comme le montre la figure 4, le pic de cette substance à analyser est légèrement plus large que prévu. Pour déterminer si ces résultats étaient dus à la co-élution interférences, des échantillons et calibrateurs ont été réanalysés en utilisant une colonne plus longue et une méthode isocratique 60 minutes. Les résultats des analyses isocratiques ont révélé un pic de co-élution avec les mêmes transitions que JWH-018 5-hydroxypentyle. Ce pic était présent dans aucun des échantillons blancs, et sur la base de ce travail, est très probablement un métabolite non documentée de JWH-018. Sur la base des travaux récents par NMS Labs, cet inconnu est très probablement JWH-018 4-hydroxypentyle [3]. Chromatographie pour la méthode isocratique ne convenait pas à la quantification, donc pas de résultats quantitatifs peut être signalé pour ce composé. Les résultats présentés pour JWH-018 5-hydroxypentyle sont la somme de JWH-018 5-hydroxypentyle et le métabolite inconnu.
Bien que JWH-073 n butanoïque est présent dans plusieurs échantillons, aucun JWH-073 4-hydroxybutyle a été détectée. Un grand pic avec les mêmes transitions que JWH-073 4-hydroxybutyle était présente dans les échantillons authentiques à un temps de rétention légèrement plus tôt que JWH-073 4-hydroxybutyle. dopage post-extraction de l'échantillon n ° 1 avec 2 ng de JWH-073 4-hydroxybutyle a confirmé que le pic observé n'a pas été due à JWH-073 4-hydroxybutyle. Le pic inconnu n'a pas été observé dans les échantillons en blanc, ce qui suggère qu'il est également un métabolite inconnu soit JWH-018 ou JWH-073. Sur la base des travaux récents par les laboratoires NMS, cet inconnu est probablement JWH-073 3-hydroxybutyle [3]. La méthode chromatographique utilisée ici était suffisante pour résoudre partiellement le composé inconnu de la norme, et le pic inconnu a été quantifiée à l'aide JWH-073 4-hydroxybutyle. Les résultats de ce métabolite inconnu doivent être considérés comme semi-quantitative.
Figure 4: échantillon authentique # 1.
Suspicion métabolite inconnu
JWH-073 acide N-butanoïque
JWH-018 acide N-pentanoïque
JWH-018 5-hydroxypentyle + métabolite inconnu
Pulvérisation ionique Tension:
40 psi (275,8 kPa)
40 psi (275,8 kPa)
40 psi (275,8 kPa)
Depuis plusieurs transitions sont partagées entre les analytes, seulement 3 transitions sont représentées pour simplifier la visualisation. Les transitions sont représentées: 344,1 / 155,1 (trace bleue), 358,1 / 155,1 (trace verte), 372,1 / 155,2 (trace grise). normes internes ne sont pas représentés.
CAD gaz a été fixé à 4 livres par pouce carré.
L'échantillon a été préparé selon la méthode suivante:
1) De Spike 1 mL échantillon d'urine à blanc avec des analytes et des normes internes.
2) Hydrolyser échantillon:
- Ajouter 1 mL de solution de bêta-glucuronidase de patelle (cat Sigma-Aldrich. # G8132). Solution est préparée à une concentration de 5000 unités Fishman / ml dans un tampon de 100 mM d'acétate d'ammonium (pH = 5,0).
- Incuber à 60 ° C pendant 3 heures.
3) Extrait échantillon sur 6 ml, 500 mg C18 haute charge postsilanisée Resprep ® cartouche SPE (cat # 24052).:
- Ajouter 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique (pH = 4,2) à l'échantillon.
- Cartouche d'état avec 3 x 1 ml d'acétonitrile.
- Cartouche d'état avec 3 x 1 ml d'acétate d'ammonium 5 mM + 0,1% d'acide acétique.
- Appliquer l'échantillon et laisser passer par gravité.
- Rincer avec 3 x 1 mL 5 mM d'acétate d'ammonium + 0,1% d'acide acétique.
- Cartouche à sec sous vide pendant 10 minutes.
- Éluer avec 3 ml d'acétonitrile suivi par 3 ml de chlorure de butyle.
4) Extrait concentré:
- Evaporer échantillon à sec sous azote à 40 ° C.
- Reconstituer dans 0,5 ml d'eau + 0,05% d'acide acétique: acétonitrile + 0,05% d'acide acétique (50:50).
Remerciements spéciaux à Cayman Chemical pour les normes de référence