La concentration d'une solution, trouver la concentration d'une solution, chimie @
Types de solutions
Trouver la concentration d'une solution
La concentration d'une solution est la quantité de soluté dissous dans une quantité connue de solvant ou d'une solution. La solution peut être décrite comme solution diluée ou concentrée selon leur concentration. Une solution diluée a une très faible quantité de soluté en solution concentrée a une grande quantité de soluté en solution. Divers termes de concentration sont les suivants.
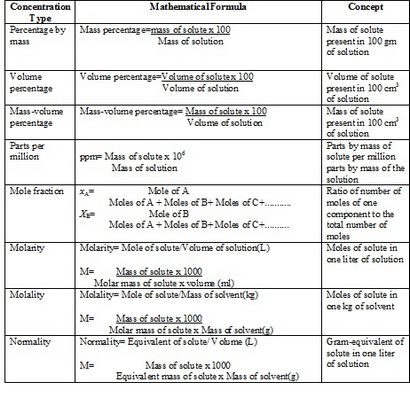
1. pourcentage de masse
% En masse = $ \ frac $ x 100 Par exemple, la composition pour cent en masse d'une solution de sucre 100 g qui contient 15 g sucre
2. Pourcentage du volume
Il peut être représenté en% v / v ou% en volume et utilisée pour préparer de telles solutions dans lesquelles les deux composants sont à l'état de liquides. Il est le nombre de parties du en volume de soluté pour cent parties en volume de solution. Donc,
Volume% = $ \ frac $ x 100%, par exemple, une solution à 20% d'éthanol en volume signifie que 100 cm 3 de la solution contient de 20 cm 3 d'éthanol et 80 cm 3 d'eau.
3. pourcentage de volume de masse (% P / V)
4. Les parties par million (ppm)
La très faible concentration de soluté en solution peut être exprimée en ppm. Il est le nombre de parties en masse de soluté par million de parties en masse de la solution.
5. Fraction molaire (X)
La fraction molaire est pas dépend de la température et peut être étendue à des solutions ayant plus de deux composants.
6. molarité (M)
Molarité est l'unité la plus courante pour la concentration de la solution. Il est défini comme le nombre de moles gramme de soluté présent dans un litre ou une dm3 de la solution ou millimoles de soluté présent dans une ml de solution.
Mathématiquement, il peut être exprimé en
- Depuis mole de soluté = masse de soluté en gramme / masse molaire de soluté
- Par conséquent, m = masse de soluté en gramme / Masse molaire du soluté x volume de solution (L)
- Si nB moles de soluté B sont présents en V litre de solution.
Où Mo est la masse molaire du soluté et WB est le gramme de soluté présent dans V (ml) de solution. Une solution molaire est défini comme la solution ayant l'unité molarité. Ces solutions ont une mole de soluté par litre de solution. L'unité de molarité est mol / L ou mol dm 3.
7. La molarité (m)
Le nombre de molécule-gramme de soluté présent dans 1000 g du solvant est connu sous le nom de molalité solution. Il représenté par la lettre « m ».
L'unité de molalité est mol / kg et il n'a pas d'effet par la température.
8. La normalité (N)
Le nombre d'équivalent-gramme de soluté présent dans un litre de solution est connue comme la normalité de la solution. En d'autres termes; nombre de milliéquivalents de soluté présent dans une mL de solution est appelée la normalité de la solution. Il représenté par la lettre « N ».
On connaît une solution ayant la normalité égale à l'unité en tant que solution normale. Une telle solution contient un équivalent-gramme de soluté par dm 3 de solution.
Calcul de la concentration d'une solution
Concentration de la solution peut être calculée en termes de normalité, molarité, ou molalité fraction molaire.
Exemples Solved
Question 1: Calculer les fractions molaires des constituants de la solution composée de 92 g de glycerol et 90 g d'eau?
(M (eau) = 18; M (glycérol) = 92)
Solution:
Moles d'eau = 90 g x 1 mol / 18 g = 5 moles d'eau
Moles de glycérol 92 g = x 1 mol / 92 g = 1 mole de glycérol
nombre total de moles dans la solution = 5 + 1 = 6 mol
fraction molaire de l'eau xwater = 5 mol / mol 6 = 0,833
fraction molaire de glycérol xglycerol = 1 mol / mol 6 = 0,167
Question 2: Quelle sera la molarité de solution lorsque l'eau est ajoutée à 10 g CaCO3 pour faire 100 ml de solution?
Solution:
10 g CaCO3 / (100 g CaCO3 / mol CaCO3) = 0,10 mol CaCO3
100 mL x 1 L / 1000 ml = 0,10 L
Molarité = Mole de soluté / Volume de la solution (L) = 0,10 mol / 0,10 L
Donc; Molarité de la solution donnée = 1,0 M
Question 3: Calculer la molalité d'une solution contenant 20 g d'hydroxyde de sodium (NaOH) dans 250 g d'eau?
Solution:
Moles d'hydroxyde de sodium = 20 g NaOH / (40 g de NaOH / 1 mol de NaOH) = 0,2 mole de NaOH
250 g = 0,25 kg d'eau (250 g d'eau x 1 kg / 1 000 g = 0,25 kg)
Par conséquent molalité de la solution = Mole de soluté / masse de solvant (kg) = 0,2 mol / 0,25 kg
ou molarité (M) = 0,8 M / kg ou 0,8 m
Question 4: Calculer le nombre de grammes de sulfate de cuivre (CuSO4) nécessaires pour préparer 250,0 mL de 1,00 M CuSO4?
Solution:
Masse molaire de sulfate de cuivre = 159,6 g / mol
V = 250 ml
Molarité = 2.00M
La concentration d'ions dans une solution
En général, nous utilisons des composés ioniques dans diverses réactions. Les composés ioniques sont bon conducteur dans leur solution aqueuse en raison de la présence d'ions en solution. Par conséquent, dans les composés ioniques de la détermination de la concentration d'ions est plus utile que la concentration de la solution. Pour la détermination de la concentration d'ions en solution, nous devons d'abord écrire l'équilibre équation chimique qui montrent comment briser ces substances vers le bas en ions.
Par exemple, la dissociation du carbonate de potassium en solution aqueuse peut être écrit de la manière suivante.
Chaque mole de K2 CO3 produit deux moles d'ions K + et deux moles d'ions carbonate en solution sans changement de volume. Maintenant, si on a une solution 0,40 M de carbonate de potassium (K2 CO3), la concentration des deux ions. K + et CO3 2- peuvent être calculées en utilisant les coefficients dans notre équation équilibrée.
La concentration de l'ion potassium, [K +] = 2 x [K2 CO3] = 2 × 0,40 = 0,80 M M
La concentration des ions carbonate [CO3 2-] = 1 × [K2 CO3] = 1 × 0,40 = 0,40 M M
Calculons la concentration d'ions dans une solution 0,30 M de fer (III) nitrate. L'équation chimique équilibrée de dissociation de fer (III) du nitrate dans la solution aqueuse est la suivante;
Concentration de [Fe 3+] = 1 × [Fe (NO3) 3] = 1 × 0,30 = 0,30 M
Concentration de [NO3 -] = 3 × [Fe (NO3) 3] = 3 × 0,30 = 0,90 M
Exemple 1
Calculer la concentration en ions dans une solution 3,00 L contenant 17,1 g de sulfate d'aluminium, Al2 (SO4) 3. (Masse atomique de Al = 27,0 g / mol, O = 16 g / mol, S = 32,0 g / mol)
Masse molaire de sulfate d'aluminium = 2 × 27,0 + 3 x 32.0.0 + 12 × 16,0 = 342,0 g / mol
La concentration de Al2 (SO4) 3 = Masse de Al2 (SO4) 3 / de la masse molaire de Al2 (SO4) 3 x V (L)
= 17,1 /342.0 x 3 = 0,0166 M
Dissociation de sulfate d'aluminium dans sa solution aqueuse peut être écrit
De l'équation équilibrée de dissociation;
La concentration de [Al 3+] = 2 x [Al2 (SO4) 3] = 2 x 0,0166 = 0,0333 M ou 3,33 × 10 -2 M
Concentration de [SO4 2-] = 3 × [Al2 (SO4) 3] = 3 x 0,0166 = 0,0498 M ou 4,98 × 10 -2 M
Quelle est la concentration des ions sodium et sulfate dans une solution 0,650 M de Na2 SO4?
on peut écrire la dissociation du sulfate de sodium dans la solution aqueuse;
La concentration des ions sodium et sulfate sera
La concentration des ions sodium; [Na +] = 0,650 M Na2 SO4 x 2Na + / Na2 SO4 1 = 1,3 M Na +
La concentration des ions sulfate; [SO4 2-] = 0,650 M Na2 SO4 2- x1SO4 / Na2 SO4 1 = 0,650 M SO4 2-
Comme Molarity est utiliser pour la concentration exprimée de la solution, la formalité est utilisée pour calculer la concentration d'ions en solution. Il est le nombre d'unités de poids de formule de soluté présent dans un litre de solution. Formalité est représenté par la lettre « F ». La masse d'une mole d'un composé est égal au poids de la formule en grammes. Formality est utilisé pour la détermination du nombre de moles d'un composé à partir du nombre de moles d'ions présents dans des solutions de composés ioniques.
Détermination de la concentration de la loi d'une solution bière
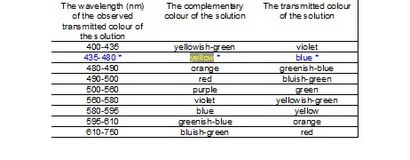
On peut décrire les propriétés de la lumière par longueur d'onde et de la fréquence. Sur la base de longueur d'onde et la fréquence, la lumière peut être classée dans divers types. Sur ces radiations, seule la lumière visible peut être vu par des yeux humains. La longueur d'onde de la lumière visible est comprise entre 400 nm et 750 nm.
Où ,
A = absorbance de la lumière à une longueur d'onde donnée -1 cm -1)
b = longueur du chemin à travers la solution que la lumière doit parcourir (cm)
c = concentration de la solution (mol / litre)
Comme l'absorption d'une couleur particulière de lumière augmente, la couleur de la solution augmente dans cette région du spectre qui ne sont pas absorbés par la solution. L'absorbance (A) est directement proportionnelle à la concentration de la solution, par conséquent, augmente avec l'augmentation de la concentration de la solution.
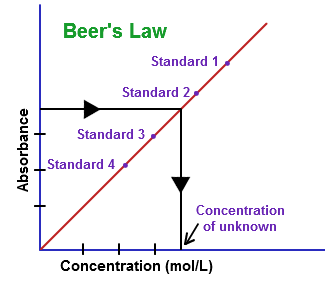
Pour la détermination de la concentration de la solution d'un échantillon inconnu, l'absorption d'une série de solution connue est mesurée et tracée qui est appelé complot de la loi de bière ou d'une courbe d'étalonnage. Cette courbe peut être utilisée pour la détermination de la concentration de l'échantillon inconnu en mesurant l'absorbance à même longueur d'onde et la longueur du trajet.
La colorimétrie est utilisée pour la détermination de la concentration de la solution qui repose sur la relation entre l'absorption et la longueur du trajet. Etant donné absorptivité molaire est unique pour chaque espèce d'absorption et de modification de longueur d'onde, donc une somme de longueur de trajet et la concentration sera de même lorsqu'il est multiplié va absorber la même quantité de lumière. Absorbance est liée à l'aspect de la solution, donc deux solutions (A1 et A2) avec la même couleur montreront même absorbance.
e 1 = e 2 (pour une même substance)
Donc
B1C1 B2C2 =
Ou
B1C1 = b2c2. (2)
La concentration de la solution inconnue peut être déterminée en utilisant l'équation (2).
- A1 = absorbance de la solution connue,
- e 1 = absorptivité molaire d'une solution connue
- c1 = concentration de la solution connue,
- A2 = absorbance de la solution inconnue
- e 2 = capacité d'absorption de Molar solution inconnue
- C2 = concentration de la solution inconnue
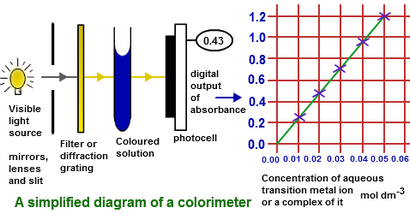
Par exemple la concentration de la solution inconnue de sulfate de nickel peut être déterminée à l'aide d'une solution connue de même composé dans colorimètre. Cette solution est connue comme solution standard et doit avoir la couleur vert foncé. Un colorimètre se compose d'une lumière rouge provenant de la source LED qui passe à travers la solution et frapper à cellule photoélectrique.
Depuis solution calomnié de sulfate de nickel est profond de couleur, donc plus concentré et absorbé plus de lumière qu'une solution de faible concentration. Cette lumière transmise est contrôlée par la cellule photoélectrique. Mesurer l'absorbance d'une série de solution connue préparée en utilisant une solution standard et des parcelles d'un diagramme entre l'absorbance et la concentration des solutions. Le graphique montre une ligne droite avec slop positive conformément à la loi de Beer-Lambert.
mesurer De même l'absorbance de la solution de sulfate de nickel inconnue avec le colorimètre. Maintenant, nous pouvons localiser l'absorbance de cette solution sur l'axe vertical du graphe et la concentration correspondante se trouve sur l'axe horizontal.