Les explosifs liquides
- Structure chimique
- propriétés chimiques et physiques: état, vitesse de détonation, brisante (effet bouleversante d'un explosif)
- La sensibilité du matériau à l'initiation (classification basée sur des considérations de sécurité)
- applications civiles et militaires des explosifs
Cet examen portera sur les propriétés chimiques et physiques des explosifs liquides (une substance explosive ou plus, lorsqu'ils traitent avec un mélange), et les principales applications dans lesquelles divers explosifs liquides sont utilisés.
Les explosifs peuvent être fabriqués à partir d'une ou plusieurs substances. Les explosifs liquides, de façon similaire à tous les autres explosifs, se trouvent dans un état métastable, ce qui permet (dans des conditions appropriées) l'apparition d'une réaction chimique rapide sans nécessiter la présence d'un réactif de l'environnement, tel que l'oxygène. explosifs liquides peuvent être déclenchées par des chocs mécaniques, les frottements ou de la chaleur.
Le développement des explosifs liquides et leur utilisation
La première explosion, nitroglycérine liquide, a été inventé en 1846 par un chimiste italien nommé Ascanio Sobrero, qui glycérine nitré avec une solution contenant de l'acide nitrique et d'acide sulfurique. Cette substance, appartenant aux esters nitro famille, a considérablement élargi la gamme d'applications dans lesquelles des explosifs pourraient être utilisés pour inclure de nouvelles applications précédemment servi que par poudre noire.
La fabrication et le transport en toute sécurité de nitroglycérine était problématique; au fil des ans, il a coûté la vie de nombreuses personnes. Lors du transport de la nitroglycérine, de petites bulles sont créées, qui sont ensuite comprimé lorsque la substance est en mouvement. Cette compression se traduit par une élévation locale, momentanée de la température et de la pression, provoquant une détonation même lorsque le mouvement est faible.
De nombreux moyens possibles de surmonter ce problème ont été examinés avant qu'une solution a été trouvée en 1860 par Alfred Nobel: le mélange nitroglycérine avec une substance solide, qui l'absorbe. Ce mélange, qui contient de la nitroglycérine et d'une argile de type Gohr Kaisal, est appelé dynamite.
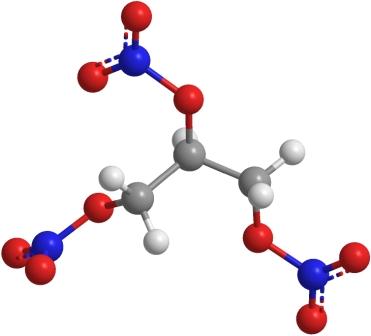
la structure chimique nitroglycérine
- Apparence: un liquide huileux clair, souvent jaunâtre
- Formule moléculaire: C3 H5 N3 O9
- poids moléculaire: 227,1 g / mol
- bilan d'oxygène: + 3,5%
- Volume des produits de détonation de gaz: 716 litres / kg
- Densité: 1,59 g / cm³
- Point de fusion: + 13,2 ° C
Les explosifs liquides supplémentaires couramment utilisés
Les propriétés explosives des nitroglycol (également connu sous le nom dinitrate éthylène glycol - EGDN) sont similaires à ceux de la nitroglycérine; cependant, il est plus de 100 fois plus volatile que la nitroglycérine, et est 4 fois plus soluble. Etant donné que la pression de vapeur de nitroglycol est beaucoup plus élevé que celui de la nitroglycérine, il peut servir un nombre relativement limité d'applications. Il est moins visqueux que la nitroglycérine, et peut accélérer la vitesse des processus de préparation de gélatine à base nitrocellulosis. Le mélange nitroglycol avec nitroglycérine dans divers dynamites permet d'utiliser les explosifs à base de dynamite dans les pays au climat froid, à basses températures où nitroglycérine gèle et est dangereux. De manière similaire à d'autres esters nitro, nitroglycol affecte également la circulation du sang; par conséquent, l'exposition à elle est dangereuse à moins que sa concentration est faible
Structure chimique d'une molécule nitroglycol
- Apparence: un liquide huileux clair, souvent jaunâtre
- Formule moléculaire: C2 H4 N2 O6
- poids moléculaire: 152,1 g / mol
- bilan d'oxygène: 0%
- Volume des produits de détonation de gaz: 738 litres / kg
- Densité: 1,48 gr / cm³
- Point de fusion: -20 ° C
- Point d'éclair: 217 ° C
le nitrate de méthyle est le produit du procédé de nitration de methanol dans lequel un mélange d'acides nitreux et de sulfate sont utilisés. Il peut également être produit par la distillation d'un mélange d'acide nitrique et de méthanol. le nitrate de méthyle est volatile, et est à peu près aussi puissant que la nitroglycérine. Il a été utilisé comme propulseur liquide dans le passé, avant d'être remplacée par une plus grande stabilité, des substances plus sûres.
La structure chimique d'une molécule de nitrate de méthyle
- Aspect: liquide clair
- Formule moléculaire: CH3 NO3
- poids moléculaire: 77,0 g / mol
- bilan d'oxygène: -10,4%
- Volume des produits de détonation de gaz: 873 litres / kg
- Densité: 1,22 g / cm³
Le nitrométhane a été développé en 1872 pour une variété d'utilisations chimiques, notamment pour servir de solvant dans des réactions chimiques, en tant que composant des détergents, comme stabilisant dans les composés chimiques et même comme carburant pour les voitures de course. Il n'a pas été considérée comme volatile dans sa forme pure jusqu'à ce que les années 1950, lorsque de nombreux accidents se sont produits comme il a été transporté.
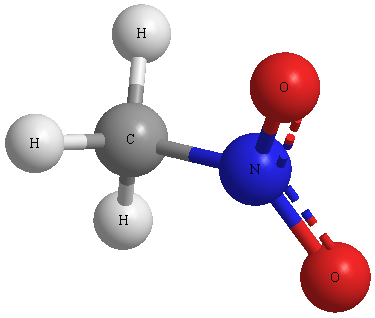
Structure chimique d'une molécule de nitrométhane
- Aspect: liquide clair
- Formule moléculaire: CH3 NO2
- poids moléculaire: 61,0 g / mol
- bilan d'oxygène: -39,3%
- Volume des produits de détonation de gaz: 1,060 litres / kg
- Densité: 1,14 g / cm³
- Vitesse de détonation: 6300 m / sec (lorsqu'il est confiné)
La structure chimique d'une molécule de peroxyde d'hydrogène

Peroxyde d'hydrogène simulant
Les mélanges de oxydants et Hydrazine - Astrolite A et G Astrolite explosifs
Aspect: liquide clair
Volume des produits de détonation de gaz: 1,112 litres / kg
Densité: 1,36 g / cm³
Vitesse de Détonation:
- Astrolite A: 7800 m / s
- Astrolite G: 8.600 m / sec
Les mélanges de peroxyde d'hydrogène et des matières organiques
Utilisation de peroxyde d'hydrogène dans des mélanges, pour agir comme un oxydant, avec diverses matières organiques, a conduit au développement de différents types d'explosifs et d'agents propulseurs d'une teneur en énergie plus élevée que l'énergie résultant de la détonation de peroxyde d'hydrogène pur. Des exemples de mélanges peuvent être trouvés dans une grande variété de brevets, dans lequel le peroxyde d'hydrogène est mélangé avec, par exemple, la farine, la sciure de bois, l'eau, la glycérine, le nitrate d'ammonium et plus.
Des exemples de tels mélanges comprennent:
Le peroxyde d'hydrogène à une concentration de 60% -90%, de la sciure, de la résine et un agent gélifiant (de l'amidon ou l'agar-agar).
peroxyde d'hydrogène à faible concentration, de la glycérine et de l'eau.
Le peroxyde d'hydrogène à des concentrations faibles ou élevées, de l'hydrazine et de l'eau, pour produire des explosifs riches en produits de détonation de gaz.
Le peroxyde d'hydrogène, le nitrate d'ammonium et de l'eau.
En 1945, un Américain nommé Ed Laurence a réussi à améliorer la performance explosive et la stabilité chimique de nitrométhane en le combinant avec des substances chimiques appartenant à la famille des amines. D'autres développements comprennent des combinaisons telles que le nitrate d'ammonium en aluminium avec divers acides.
En principe, toute amine peut être utilisé pour préparer un explosif nitrométhane; Cependant, les meilleurs résultats sont obtenus lors de l'utilisation aliphatique, et non des amines aromatiques. Les amines recommandées comprennent l'acide éthylènediamine-morpholine, diethlaminoethanol; et Aniline et tétraéthylènepentamine.
PLX, qui a été utilisé dans le passé pour la détonation à distance des mines terrestres, est produit en combinant nitrométhane à 95% avec 5% éthylènediamine. les dérivés d'amines supplémentaires ont été essayés; Cependant, ce qui précède a été constaté que le rapport le plus efficace pour une substance explosive.
En 1987, un engin explosif combinant C4 et PLX a été utilisé pour faire exploser un vol Korean Airlines 858. Le dispositif a été réalisé à bord par des agents nord-coréens.
Ces gélatines contiennent du nitrométhane, d'un dérivé d'amine, une substance épaississante et de l'aluminium.
Des exemples de ce type de mélanges comprennent:
- Le nitrométhane, le nitrocellulose, l'éthylènediamine et de la poudre d'aluminium
- Nitrométhane, Benton 38, la poudre de l'éthylènediamine et de l'aluminium
Annm, Nitrate d'ammonium - nitrométhane
Des combinaisons d'acide nitrique et des matières organiques
Hellhoffites sont l'une des premières familles comprenant des explosifs liquides qui sont mélangés avec le dinitrobenzène ou dinitrochlorobenzène et de l'acide nitrique concentré. Ces mélanges ont été largement utilisés pour la plupart de 1880 à 1897; au cours des années plus tard, leur utilisation a été considérablement réduite en raison de problèmes de stabilité et de sécurité. Dinitrobenzène a d'abord été synthétisé par St. C. Deville en 1841 dans un processus qui est similaire au procédé de fabrication de TNT (réaction réflexe du benzène avec de l'acide nitrique concentré). En changeant les rapports des isomères DNB (orto, meta, para) et les différents paramètres de compression, des mélanges avec la viscosité désirée ont été obtenus et la densité. Ceux-ci sont connus sous le nom Boloron; ils étaient utilisés en Autriche après la Seconde Guerre mondiale.
Les Hellhoffites sont connus aux Etats-Unis sous le nom de dithekite; ils contiennent des rapports différents de nitrobenzène et d'acide nitrique. Dithekite 13 est un mélange spécifique, qui est aussi la plus courante; le chiffre 13 indique le pourcentage de l'eau; à savoir dithekite 13 se compose d'acide nitrique / benzène / eau nitro en un rapport de 63/24/13.
Oxonites encore une autre famille de mélanges, dans lequel l'acide picrique remplace nitrobenzène.
mélanges supplémentaires à base d'acide nitrique et de composés organiques ont été développés au cours du 20ème siècle, au cours des années 1970, un mélange d'émulsion a été développée en mélangeant de l'acide nitrique concentré avec du nitrate d'ammonium et de composés stabilisants, résultant en des explosifs gélatineux et des émulsions stables. Les inconvénients de ces types de mélanges comprennent leurs propriétés corrosives, qui rendent leur stockage et leur utilisation problématique; ainsi que la toxicité des dinitrobenzène.
Dans les explosifs appartenant à la famille de l'émulsion de l'oxydant est introduit sous la forme d'une solution aqueuse dans une phase huileuse par un émulsifiant. Ces substances peuvent être déclenchées au moyen d'un détonateur après addition de bulles de gaz ou des micro-ballons, au cours du processus de fabrication. Les principaux éléments constitutifs de ces explosifs sont l'eau, un oxydant, un agent épaississant, la matière organique, et dans le cas d'explosifs en forme de capuchons sensible - des bulles de gaz ou des micro-ballons. Ces substances ont une texture analogue à une pâte gélatineuse et contiennent d'autres additifs, tels que poudre d'aluminium.
Les substances appartenant à cette famille, qui contiennent une solution de nitrate d'ammonium saturée, ont été développés dans le but d'améliorer la résistance à l'eau des substances explosives. Cela a été fait par addition d'eau en même temps que des agents gélifiants à la substance explosive elle-même, réalisant ainsi deux objectifs: imperméabilise il; et l'augmentation de sa densité à la densité de l'eau ci-dessus. Ces améliorations ont permis d'utiliser ces explosifs dans des endroits humides (principalement les forages dans les mines).
De même à la famille de l'émulsion, de type gel de l'eau capuchon sensible à des substances explosives peuvent également être fabriqués, en ajoutant des matériaux tels que le mono nitrate de méthylamine et d'autres matériaux métalliques, ou en ajoutant des bulles et des micro-ballons.
M. Avi Icar est le fondateur et PDG de A.I. Inspection des explosifs - Services. Il est diplômé avec mention de l'École de chimie Université de Tel Aviv, et a servi comme officier dans une neutralisation des explosifs et munitions (NEM) Unité des Forces de défense israéliennes, puis comme technicien NEDEX et intégrateur de technologies de détection à l'Agence israélienne de sécurité.