Les réactions de décomposition et de synthèse - Vidéo & Transcript Leçon
Des scientifiques comme l'ordre et la prévisibilité. Ils aiment savoir où les choses sont, où ils appartiennent et comment ils se rapportent les uns aux autres. Il aide les scientifiques à voir les modèles et les similitudes entre les choses apparemment différentes. Vous avez appris qu'il ya des millions de réactions chimiques qui se produisent tous les jours, partout, tout autour de vous. Pour comprendre tous les différents types de réactions plus facile, ils sont classés en plusieurs types afin prédictions peuvent être faites à leur sujet.
Revoyons quelques mots de vocabulaire. Rappelez-vous qu'un réactif est une substance qui participe à une réaction chimique. Un produit est une substance qui se forme dans une réaction chimique. Maintenant, nous pouvons parler d'une réaction chimique. qui est en une ou plusieurs substances changent pour produire une substance différente.
L'identification d'une réaction de synthèse
Le premier type de réaction que nous allons parler est la réaction de synthèse. On entend par «synthèse de» pour mettre ensemble, et que cette réaction est ce que fait - il faut deux ou plus réactifs et les met ensemble pour former un seul composé. Une réaction de synthèse est une réaction dans laquelle deux substances ou plus se combinent pour former un nouveau composé.
Lorsque deux éléments se combinent dans une réaction de synthèse, le seul produit qui peut être faite est un composé binaire. Un composé binaire est un composé constitué de deux éléments seulement: A + B = AB ou C + O2 = CO2. Si un métal réagit avec un non-métal, il se forme un composé ionique parce que les électrons sont transférés d'un atome à l'autre. Avec ce genre de réaction, il est facile de prédire le produit parce que les charges sur les ions de chaque aide de réactif vous déterminez le nombre de chaque atome il faut. Lorsque réagissent les uns avec les non-métaux autres, il est plus difficile de prédire le produit. En effet, elles peuvent se combiner en plusieurs formes différentes. Par exemple, le carbone et l'oxygène, C et O2, peuvent se combiner pour faire du CO2, ou ils peuvent se combiner pour faire CO (C + O2 = CO2 ou 2C + O2 = 2CO).
Quand un métal ou non-métal réagissent les uns avec les autres, est créé un composé ionique.
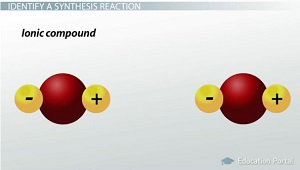
Si deux composés se combinent dans une réaction de synthèse, on peut former un composé ternaire. qui est un composé constitué de trois éléments. AB + BC = ABC ou le dioxyde de carbone se combine avec l'eau pour fabriquer de l'acide carbonique: CO2 + H2O = H2CO3.
Prédire une réaction de synthèse
Vous pouvez prédire ce qui se forme dans une réaction de synthèse en regardant ce qui est de réagir.
Les réactions avec l'oxygène
Lorsqu'un élément se combine avec l'oxygène, il crée un oxyde de l'élément. Fer réagit avec l'oxygène pour produire un oxyde de fer: 2Fe + O2 = 2FeO.
Les réactions des deux Métalloïde
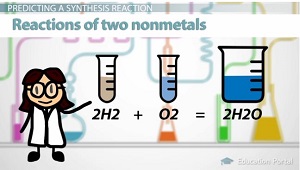
Lorsque deux éléments non métalliques réagissent, ils forment un composé covalent. L'eau est un exemple. L'hydrogène ainsi que l'oxygène fait l'eau: 2H2 + O2 = 2H2O.
Quand un élément non métallique réagit avec l'oxygène, il se forme des composés covalents.
Les réactions des métaux avec Métalloïde autres que l'oxygène
Quand un métal et non métalliques réagissent, ils forment souvent un composé ionique, en général un sel. Sodium et le chlorure se combinent pour former le sel de table: 2Na + Cl2 = 2NaCl.
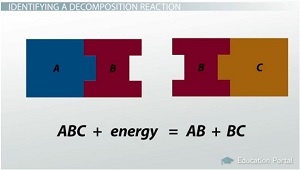
Si le réactif est un composé binaire, les seuls produits qu'il peut faire sont les éléments du réactif: AB + énergie = A + B. 2H2O + électricité = 2H2 + O2. Si un réactif est constitué d'un composé complexe de trois éléments ou plus, il ne sera généralement pas briser dans ses éléments individuels, mais plutôt se briser en composés: ABC + énergie = AB + BC.
Composé complexe ne se décomposer en ses éléments individuels.
Une réaction de synthèse est une réaction dans laquelle deux substances ou plus se combinent pour former un nouveau composé. Lorsque deux éléments se combinent dans une réaction de synthèse, le seul produit qui peut être faite est un composé binaire: A + B = AB. Si deux composés se combinent dans une réaction de synthèse, ils peuvent former un composé ternaire, qui est un composé constitué de trois éléments: AB + BC = ABC.
Résultats d'apprentissage
A partir de cette leçon, vous apprendrez à:
Pour déverrouiller cette leçon, vous devez être membre Study.com.
Créez votre compte
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.