Loi de Dalton des pressions partielles Calcul des pressions partielles et totales - Vidéo & Transcript Leçon
Vidéo: la loi de Dalton des pressions partielles: Calcul partiel Les pressions totales
Dans cette leçon, vous apprendrez comment les gaz se comportent quand ils sont mélangés et comment utiliser la loi de Dalton des pressions partielles pour le calcul des pressions partielles et totales de gaz. Vous apprendrez également comment utiliser ces informations pour expliquer comment trouver la pression partielle d'un gaz recueilli sur l'eau.
Regardez court - vidéos amusantes Commencez votre essai gratuit aujourd'hui
Une erreur est survenue en essayant de charger cette vidéo.
Vous devez créer un compte pour continuer à regarder
Inscrivez-vous pour un essai gratuit
Vous êtes étudiant ou un enseignant?
Quel est votre objectif éducatif?
Commencez votre essai gratuit pour continuer à regarder
En tant que membre, vous aurez également un accès illimité à plus de 55 000 cours en mathématiques, anglais, sciences, histoire, et plus encore. De plus, obtenez des tests pratiques, des quiz, et un coaching personnalisé pour vous aider à réussir.
Il ne faut que quelques minutes pour mettre en place et vous pouvez annuler à tout moment.
Déjà enregistré? Connectez-vous ici pour accéder
Dans cette leçon, vous apprendrez comment les gaz se comportent quand ils sont mélangés et comment utiliser la loi de Dalton des pressions partielles pour le calcul des pressions partielles et totales de gaz. Vous apprendrez également comment utiliser ces informations pour expliquer comment trouver la pression partielle d'un gaz recueilli sur l'eau.
Mélanges de gaz
Ce fut une journée chaude et humide sur l'île Idéal, l'endroit où tous les gaz se comportent idéalement. Rappelez-vous, les gaz parfaits déplacer rapidement et au hasard, ils ne sont pas attirés les uns aux autres, et ils ont des collisions élastiques, ce qui signifie quand ils entrent en collision il n'y a pas de perte d'énergie. Johnny Dalton et sa famille sont en vacances sur l'île, et il arrive d'être l'un des a connu les jours les plus humides Johnny. Cela lui arrive de penser à l'humidité et les particules dans l'air.
Pression partielle d'un gaz
En utilisant la loi des pressions partielles pour trouver la pression des gaz individuels dans l'atmosphère

Loi des pressions partielles de Dalton
Ce phénomène est tellement important qu'il a été nommé d'après Dalton. Il est devenu connu comme la loi de Dalton des pressions partielles. et il indique simplement que la pression totale exercée par un mélange de gaz est égale à la somme des pressions partielles de chaque gaz individuel. Nous pouvons aussi regarder cette loi sous forme d'équation.
Pour revenir à l'exemple précédent de mélange, la pression partielle de l'azote était de cinq mmHg, et la pression partielle de l'oxygène était de quatre mmHg. La pression totale du mélange était neuf mmHg. Cette loi peut être utilisé avec un certain nombre de composants de gaz, mais il suppose que chaque gaz se comporte idéalement et de façon indépendante. Rappelez-vous que les gaz parfaits ont pas de forces intermoléculaires, de sorte qu'ils ne touchent pas les uns des autres, ce qui signifie que chaque particule de gaz individu a une chance égale de frapper le mur et faisant pression, et la pression totale est le résultat de toutes les collisions de la les particules ont avec les parois du récipient. Cette loi suppose également que les gaz dans le mélange ne réagissent pas les uns avec les autres.
Nous pouvons utiliser cette équation pour trouver la pression de chaque gaz séparé dans l'atmosphère. Dire la pression atmosphérique totale sur l'île est de 760 mmHg (ce qui est probablement la pression de l'atmosphère au niveau de la mer). La pression de chaque gaz dans l'atmosphère devrait totaliser 760 mmHg. Si 78% de l'atmosphère est de l'azote, puis autour de 593 mm Hg (78% de 760) seraient pression exercée en raison de l'azote. 152 mm Hg de la pression serait due à l'oxygène (qui est 20% de 760), et le reste de la pression (15 mmHg) proviendrait des autres gaz dans l'atmosphère.
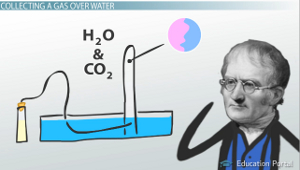
La collecte d'un gaz sur l'eau
La pression totale des gaz dans le tube à essai doit être égale à la quantité de pression à l'extérieur du tube
déverrouiller contenu
Plus de 55 000 leçons dans tous les sujets majeurs
Accès GRATUIT pour 5 jours,
il suffit de créer un compte.
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.