Les types de réactions chimiques et réactions Double simple déplacement
Ce livre est distribué sous licence une licence Creative Commons by-nc-sa 3.0. Voir la licence pour plus de détails, mais cela signifie, fondamentalement, vous pouvez partager ce livre aussi longtemps que vous citez l'auteur (mais voir ci-dessous), ne font pas d'argent de lui, et ne le rendre accessible à tout le monde dans les mêmes termes.
copies PDF de ce livre ont été générés à l'aide du Prince. un excellent outil pour faire des fichiers PDF en HTML et CSS. Plus de détails sur le processus sont disponibles dans ce billet de blog.
Est-ce que ce livre vous a aidé? Pensez à passer sur:
Creative Commons soutient la culture libre de la musique à l'éducation. Leurs licences ont contribué à faire ce livre à votre disposition.
DonorsChoose.org aide les gens comme vous aider les enseignants à financer leurs projets de classe, de fournitures d'art aux livres à des calculatrices.
Section précédente
Table des matières
Section suivante
4.2 Types de réactions chimiques: Les réactions simple et double déplacement
Objectifs d'apprentissage
- Reconnaître les réactions chimiques comme des réactions de remplacement simple et réactions à double remplacement.
- Utilisez le tableau périodique, une série d'activités, ou des règles de solubilité pour prédire si les réactions de remplacement simple ou des réactions à double remplacement se produiront.
Jusqu'à présent, nous avons présenté des réactions chimiques comme sujet, mais nous n'avons pas discuté comment prédire les produits d'une réaction chimique. Ici, nous allons commencer notre étude de certains types de réactions chimiques qui nous permettent de prédire ce que les produits de la réaction seront.
Une réaction de remplacement unique Une réaction chimique dans laquelle un élément est substitué à un autre élément dans un composé. est une réaction chimique dans laquelle un élément est substitué à un autre élément dans un composé, la génération d'un nouvel élément et un nouveau composé sous forme de produits. Par exemple,
Ici, les changements d'ions chargés négativement du chlorure de fluorure. Une caractéristique typique d'une réaction simple remplacement est qu'il y a un élément en tant que réactif et un autre élément en tant que produit.
Toutes les réactions unique de remplacement proposées se produire entre deux réactifs donnés. Ceci est le plus facilement démontrée par le fluor, le chlore, le brome et l'iode. Collectivement, ces éléments sont appelés les halogènes et sont en avant-dernière colonne du tableau périodique (voir la figure 4.1 « Halogènes sur le tableau périodique »). Les éléments sur le dessus de la colonne remplaceront les éléments ci-dessous les sur le tableau périodique, mais pas l'inverse. Ainsi, la réaction représentée par
se produira, mais la réaction
ne sera pas parce que le brome est au-dessous du fluor sur le tableau périodique. Ceci est juste l'une des nombreuses façons dont le tableau périodique nous aide à comprendre la chimie.
Figure 4.1 Halogènes sur le Tableau Périodique
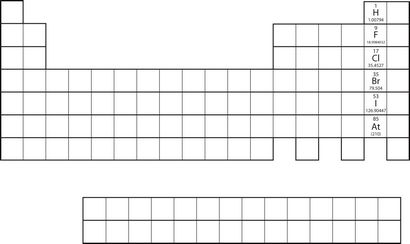
Les halogènes sont les éléments suivant à la dernière colonne du tableau périodique.
Se produira une réaction unique de remplacement? Si oui, identifier les produits.
- Parce que l'iode est au-dessous du chlore sur le tableau périodique, une réaction unique de remplacement ne se produira pas.
- Parce que le fluor est au-dessus du brome sur le tableau périodique, une réaction simple remplacement se produit, et les produits de la réaction sera CaF2 et BR2.
Se produira une réaction unique de remplacement? Si oui, identifier les produits.
Série d'activité pour Cation de remplacement dans les réactions simple remplacement
Utilisation de la série d'activités est similaire à l'utilisation des positions des halogènes sur le tableau périodique. Un élément sur le dessus va remplacer un élément au-dessous, dans les composés subissant une réaction simple remplacement. Les éléments ne seront pas remplacer les éléments ci-dessus dans les composés.
Utilisez la série d'activités pour prédire les produits, le cas échéant, de chaque équation.
- Parce que le zinc est au-dessus du fer dans la série d'activités, il remplacera le fer dans le composé. Les produits de cette réaction de remplacement unique sont ZnCl2 et Fe.
- L'or est en dessous de l'hydrogène dans la série d'activités. En tant que tel, il ne sera pas remplacer un atome d'hydrogène en un composé avec l'ion nitrate. Aucune réaction est prédite.
Utilisez la série d'activités pour prédire les produits, le cas échéant, de cette équation.
Une réaction à double remplacement Une réaction chimique dans laquelle des parties de deux composés ioniques sont échangés. se produit lorsque deux parties de composés ioniques sont échangés, ce qui rend les deux composés nouveaux. Une caractéristique d'une équation à double remplacement est qu'il y a deux composés en tant que réactifs et deux composés différents en tant que produits. Un exemple est
Il y a deux façons de considérer l'équivalent d'une équation à double remplacement: soit les cations sont échangés, ou les anions sont permutées. (Vous ne pouvez pas échanger les deux, vous finiriez avec les mêmes substances que vous avez commencé avec.) De toute perspective devrait vous permettre de prévoir les produits appropriés, aussi longtemps que vous associez un cation avec un anion et non un cation avec un cation ou un anion avec un anion.
En pensant à la réaction que soit la commutation des cations ou la commutation des anions, nous prévoyons que les produits soient BaSO4 et NaCl.
Prédire si une double réaction de remplacement se produit est un peu plus difficile que de prévoir une réaction simple remplacement. Cependant, il y a un type de réaction double remplacement que l'on peut prédire: la réaction de précipitation. Une réaction de précipitation, une réaction chimique dans laquelle deux composés ioniques sont dissous dans l'eau et former un nouveau composé ionique qui ne dissout pas. se produit lorsque deux composés ioniques sont dissous dans l'eau et former un nouveau composé ionique qui ne dissout pas; ce nouveau composé se situe hors de la solution sous forme de précipité solide Un solide qui tombe hors de la solution dans une réaction de précipitation. La formation d'un précipité solide est la force motrice qui fait la réaction se déroule.
Pour juger si les réactions à double remplacement auront lieu, nous avons besoin de savoir quels types de composés ioniques forment des précipités. Pour cela, nous utilisons des règles de solubilité déclarations générales qui permettent de prédire quels composés ioniques et qui ne se dissolvent pas. qui sont des états généraux qui permettent de prédire quels composés ioniques se dissolvent (sont solubles) et qui ne sont pas (ne sont pas solubles ou insolubles). Tableau 4.1 « Quelques règles utiles solubilité » énumère certaines règles de solubilité générales. Nous devons considérer chaque composé ionique (à la fois les réactifs et les produits possibles) à la lumière des règles de solubilité dans le tableau 4.1 « Quelques règles utiles » solubilité. Si un composé est soluble, on utilise l'étiquette (aq) avec elle, indiquant qu'il se dissout. Si un composé n'est pas soluble, on utilise l'étiquette (s) avec et supposons qu'il va précipiter hors de la solution. Si tout est soluble, aucune réaction sera attendue.
Tableau 4.1 Quelques règles utiles solubilité
Ces composés se dissolvent généralement dans de l'eau (sont solubles):
Les composés de Li +. Na +. K +. Rb +. Cs +. NH4 +. Sr 2+. et Ba 2+
Vous vous attendez à voir un changement visuel correspondant à SrSO4 précipiter hors de la solution (Figure 4.2 « Les réactions Double-remplacement »).
Figure 4.2 Réactions Double-remplacement

Certaines réactions à double remplacement sont évidents parce que vous pouvez voir un précipité solide en sortant de la solution.
Se produira une réaction double de remplacement? Si oui, identifier les produits.
Se produira une équation double de remplacement? Si oui, identifier les produits.
Pas de réaction; tous les produits possibles sont solubles.
points clés
- Une réaction de remplacement unique remplace un élément à un autre dans un composé.
- Le tableau périodique ou une série d'activités peuvent aider à prédire si les réactions de remplacement unique se produisent.
- Une réaction de double échange de remplacement des cations (ou les anions) de deux composés ioniques.
- Une réaction de précipitation est une réaction à double remplacement dans laquelle un produit est un précipité solide.
- règles de solubilité sont utilisés pour prédire si certaines réactions à double remplacement se produiront.
Quelles sont les caractéristiques générales qui vous aident à reconnaître les réactions de remplacement unique?
Quelles sont les caractéristiques générales qui vous aident à reconnaître les réactions à double remplacement?
En supposant que chaque réaction de remplacement unique se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction de remplacement unique se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction de remplacement unique se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction de remplacement unique se produit, prédire les produits et écrire chaque équation chimique équilibrée.
Utilisez le tableau périodique ou la série d'activités pour prédire si chaque réaction de remplacement unique se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez le tableau périodique ou la série d'activités pour prédire si chaque réaction de remplacement unique se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez le tableau périodique ou la série d'activités pour prédire si chaque réaction de remplacement unique se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez le tableau périodique ou la série d'activités pour prédire si chaque réaction de remplacement unique se produit et, le cas échéant, écrire une équation chimique équilibrée.
En supposant que chaque réaction double remplacement se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction double remplacement se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction double remplacement se produit, prédire les produits et écrire chaque équation chimique équilibrée.
En supposant que chaque réaction double remplacement se produit, prédire les produits et écrire chaque équation chimique équilibrée.
Utilisez les règles de solubilité pour prédire si chaque réaction double remplacement se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez les règles de solubilité pour prédire si chaque réaction double remplacement se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez les règles de solubilité pour prédire si chaque réaction double remplacement se produit et, le cas échéant, écrire une équation chimique équilibrée.
Utilisez les règles de solubilité pour prédire si chaque réaction double remplacement se produit et, le cas échéant, écrire une équation chimique équilibrée.