Remplacement unique Réaction - Définition, Comment faire et exemples, chimie @
Il y a le remplacement continu va autour de nous tous les jours. De même, il y a des remplacements qui se produisent dans nos réactions chimiques aussi. Ces réactions sont nommés comme ctions rea de remplacement. Lorsqu'une seule substance est remplacée par l'autre, les réactions sont appelées des réactions de remplacement simples.
Le remplacement se produisent habituellement lorsque le remplacement a une plus grande stabilité et la stabilité. De la même manière, les éléments avec une réactivité plus élevée avec une réactivité remplacement des éléments plus faible. Il y a nombre de réactions de remplacement simples qui se produisent autour de nous des industries aux laboratoires chimiques.
Remplacement unique Définition de réaction
réaction de remplacement unique est un type de réaction dans laquelle l'un des réactif remplace l'ion dans l'autre réactif. Il est une réaction chimique dans laquelle un élément ou ion est l'ion remplace ou d'un élément présent dans le composé. La représentation générale de la réaction de remplacement est
A + BC $ \ $ s AB + C
Où A est un ion ou d'un élément et BC est la composition composé de l'élément B et C. Lorsque la réaction de déplacement d'ions se produit ou élément C est remplacé par élément ou ion A.
Le remplacement ne peut se produire lorsque l'élément de remplacement est plus réactif que celui qui est maintenant remplacé. Voilà pourquoi ces réactions ne peuvent pas être inversées. Il est aussi appelé seule réaction déplacemen t.
Exemples de remplacement simple réaction
Il existe plusieurs exemples de réaction unique de remplacement. Un exemple peut être pris à partir de l'industrie sidérurgique, où le fer est déplacé de la solution d'oxyde de fer (II), en utilisant des co ke (une forme de charbon). La réaction est représentée par:
Un autre exemple peut être tiré de la statue de la liberté. La statue de la liberté à l'intérieur est composé de fer. Au-dessus de ce qu'il est revêtu de cuivre. Après un certain temps le cuivre sur le dessus début ed réaction avec de l'air, et un revêtement vert bleuâtre est formée sur la statue. Le revêtement bleu-vert commence à réagir avec le fer à l'intérieur de la statue et une seule réaction de remplacement se produit, dans lequel le fer est oxydé en oxyde de fer et de cuivre à l'extérieur est remplacé avant.
Il y a encore de nombreuses réactions de remplacement unique se déroulant dans ou laboratoires chimiques et notre vie quotidienne.
Lorsque le zinc se combine avec l'acide chlorhydrique, zinc remplace un atome d'hydrogène. La réaction chimique peut être représenté comme
De même, le fer, le sodium et tous les éléments ci-dessus peut déplacer l'hydrogène et produire de l'hydrogène gazeux. Les réactions sont les
Un autre exemple peut être pris des industries qui fabriquent des produits de construction. La chaux (calcium) lorsqu'il est mélangé avec de l'eau produit de l'hydroxyde de calcium avec dégagement de gaz hydrogène.
Comment faire Les réactions de remplacement simples?
réaction de remplacement unique se produit lorsqu'un élément remplace un autre élément dans le composé. Ce remplacement a lieu lorsque l'élément plus réactif remplace l'élément moins réactif. Un métal moins réactif est remplacé par un métal plus réactif et un moins non métallique est remplacé par le non-métal plus réactif dans la réaction de remplacement unique.
Comment savons-nous de la réactivité d'un élément?
Il est la série d'activités qui nous renseigne sur la réactivité d'un élément. L'activité est la capacité d'un élément à réagir avec un autre élément. Plus l'activité plus réactive est l'élément. Dans la série des activités, les éléments sont disposés en fonction de leurs activités. Les éléments ayant une activité supérieure ou une réactivité plus élevée se trouvent sur la partie supérieure de la série tandis que l'activité, celles qui sont les moins réactifs réside ci-dessous.
Voici la série d'activités.
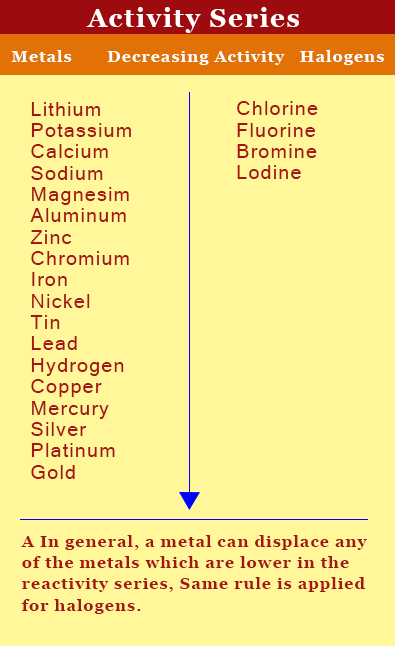
Le métal située au-dessus peut remplacer tout métal se trouvant en dessous. Mais le métal se trouvant en dessous ne peut pas remplacer les métaux se trouvant au-dessus de la série d'activités. Par exemple lithium présente sur la partie supérieure de la série d'activités peut remplacer tous les métaux en dessous. De même pour les non-métaux tels que les halogènes non-métallique allongé ci-dessus peut remplacer un non-métal se trouvant en dessous. Par exemple, Fluor est plus réactif que le chlore, le brome et l'iode. Par conséquent, Fluor peut facilement remplacer le chlore, le brome ou l'iode.
De cette manière, l'apparition de la réaction peut être prédite. Si l'élément qui remplace l'autre élément supérieur en série d'activités, la réaction se produira, si elle est inférieure à la réaction ne se produira pas.
Par exemple: Dans la réaction entre le cuivre et le nitrate d'argent, de métal d'argent et une solution de nitrate de cuivre bleu est produit. La réaction a eu lieu parce que le cuivre est plus réactif que l'argent. La réaction est représentée par:
Un autre exemple peut être du fer réagir avec le nitrate de cuivre, étant donné que le fer est plus réactif que le cuivre, il se produit réactionnel et coper est remplacée par du fer.
Mais une réaction entre le cuivre et le fer (II) nitrate ne se produira que le cuivre ne peut pas remplacer le fer de solution de nitrate de fer (II).
De la même manière, les halogènes qui sont plus réactifs peuvent remplacer les halogènes qui sont moins réactifs. Par exemple, lorsque du chlore gazeux est passé à travers une solution de bromure de sodium, le chlorure de sodium est produit. Cela est dû à la réactivité plus de chlore que le brome.