Osmose inverse
M mélanges d'eau de mer artificielle utilisent aquariophiles ost, et ceux-ci doivent toujours être fait avec l'eau douce. De même, tous les récifs ont besoin aquariums leur eau évaporée être remplacée par l'eau douce d'une certaine façon. Par conséquent, tous les aquariophiles doivent avoir accès à l'eau douce convenablement pure. Malheureusement, l'eau du robinet contient souvent des contaminants, y compris le chlore, chloramines. le cuivre, et une variété d'autres composés indésirables, qui le rendent impropre à l'usage d'aquarium. Il existe plusieurs façons de purifier l'eau du robinet pour la rendre appropriée pour l'aquariophilie récifale et la meilleure méthode pour y parvenir est probablement la combinaison de purification par osmose inverse et désionisation (RO / DI).
Cet article décrit ce que ces systèmes multicellulaires sont composés de, ce que chaque étape accomplit et comment tirer le meilleur parti d'un système d'osmose inverse / DI. Plus précisément, le contenu sont les suivants:
Qu'est-ce que les contaminants sont présents dans l'eau du robinet?
T eau ap peut contenir une variété d'impuretés indésirables. Certains sont présents dans la source d'eau douce avant d'être recueillis par une entreprise d'approvisionnement en eau municipale. Ceux-ci peuvent inclure des nitrates. phosphate. silice. certains métaux potentiellement toxiques (tels que le chrome), et une variété de matières organiques (tableaux 1-4).
Une partie du charbon actif oxydé reste, et quelques ventile pour produire l'oxygène (O2):
Aucun des produits de réactions 2 ou 3 est source de préoccupation pour aquariophiles.
La réaction de chloramine (NH 2 Cl) sur charbon actif est un peu plus compliqué, et produit de l'ammoniac (NH 3), du chlorure (Cl -), et de l'azote gazeux (N 2). Les équations 4 et 5 montrent les processus.
Contrairement à la dégradation par le chlore, l'un des sous-produits de dégradation de la chloramine, en particulier l'ammoniac, est une préoccupation importante pour récifalistes. L'ammoniac passera assez facilement à travers une membrane d'osmose inverse (voir plus loin dans cet article), mais s'il y a un système de DI, il devrait éliminer efficacement l'ammoniac.
Inverser Membranes Osmose
CTA membranes sont peu coûteux et résistant à l'oxydation par le chlore.membranes FDSP sont généralement optimale que dans des situations particulières, comme l'eau de source très douce.
Si les tailles des pores sont faites juste un peu plus grand que les molécules d'eau de la membrane, puis de l'eau peut passer à travers eux, mais les composés plus grandes ne peut pas. Taille dans ce cas est une idée quelque peu simplifiée. De nombreux ions sont plus petits qu'une molécule d'eau (Figure 3), mais il se trouve que les ions chargés (tels que le sodium, Na +) en solution contiennent plusieurs molécules d'eau très étroitement liés. Retrait de l'ensemble de ces molécules d'eau attachées nécessite beaucoup d'énergie, de sorte que lors du passage à travers une membrane poreuse, ils agissent comme si elles sont aussi grande que la totalité de l'ensemble de suspension (Figure 4). Ces grands assemblages ne peuvent pas passer à travers une membrane d'osmose inverse aussi facilement qu'ils pourraient sans les molécules d'eau étroitement liées (Figure 5).

Figure 3. tailles comparatifs d'une molécule d'eau (H 2 O; droite)
et un ion sodium nu (Na +; à gauche).
En outre, afin d'obtenir un débit suffisamment rapide de l'eau à travers la membrane, la membrane pores sont en fait beaucoup plus grande qu'une molécule d'eau. Pour cette raison, certaines des molécules de composés qui sont un peu plus grande qu'une molécule d'eau peut encore passer à travers (ion sodium, par exemple, est pas parfaitement rejeté).
Toutefois, à la petite extrémité du spectre, un certain nombre de composés peut passer à travers une membrane d'osmose inverse dans une certaine mesure et sont, par conséquent, de préoccupation pour récifalistes. Ceux-ci comprennent le dioxyde de carbone (CO 2), l'ammoniac (NH 3), l'hydrogène sulfuré (H 2 S, en particulier un problème avec l'eau de puits) et de l'acide silicique (Si (OH) 4 qui est sous forme de silicate non chargé et prédomine à un pH des valeurs inférieures à 9,5). Tous ces éléments doivent être pris au piège par une résine DI fonctionnement (voir ci-dessous), mais peut encore être une préoccupation.
Dans le cas de l'acide silicique, certains types de membranes d'osmose inverse peut être mieux que d'autres à l'exclure, même avant qu'il ne soit aux résines DI. Par exemple, une membrane en polyamide à film mince peut laisser seulement 0,3% du col de l'acide silicique. tandis qu'une membrane d'acétate de cellulose similaire pourrait laisser 12,7% de passer.
Pour fonctionner correctement, la membrane d'osmose inverse est couplée à un limiteur de débit qui permet de construire la pression sur le côté amont de la membrane, plutôt que de laisser l'eau simplement manquer de l'appareil et dans le drain. Cette pression aide la force les molécules d'eau (et d'autres petites molécules) à travers la membrane. Après avoir passé à travers les pores, l'eau continue ensuite à la résine DI.
Pour attraper ces ions, la résine est constituée de perles poreuses qui ont des charges fixes qui leur sont rattachés. Les contre-ions de ces charges fixes commencent comme H + et OH - dans une résine fraîche. Normalement, il y a des billes différentes destinées à se lier à des cations et des anions. Dans une résine mixte lit DI, les billes sont mélangées ensemble dans un seul filtre. Dans un système à lit séparé, chaque type de cordon sera dans un filtre différent, ce qui permet potentiellement le DI à être rechargée (un processus qui est discuté plus loin dans cet article).
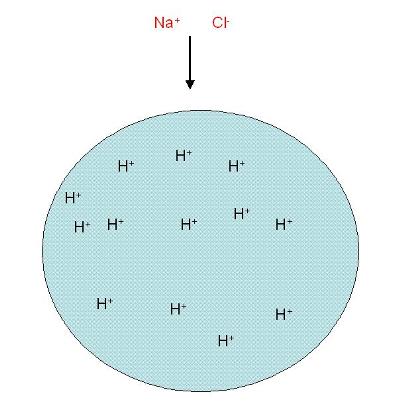
Figure 9. Une résine liant les anions, qui montre comment un ion chlorure (Cl -) reçoit
échangé contre un ion hydroxyde (OH -). Cette perle par conséquent
convertit une solution de chlorure d'hydrogène dans de l'eau seule.
Désionisation résine Questions déplétion
E ventually, la totalité de la H + et OH - initialement installé dans une résine DI deviendra appauvri, et les ions passeront au travers inchangée (Figure 10). Lorsque les ions chargés commencent à passer à travers la résine DI, la conductivité de l'effluent augmente. De nombreux systèmes RO / DI utilisent un appareil de mesure de conductivité en ligne pour avertir les utilisateurs lorsque des ions commencent à apparaître, ce qui indique que la résine doit être remplacée. Sans un tel compteur en ligne, les utilisateurs doivent surveiller périodiquement la conductivité de l'effluent (en m S / cm ou ppm TDS, les détails sont donnés dans la section des conseils sur ce que la conductivité à cibler pour le remplacement de résine).
Figure 10. Une résine de liaison cationique représenté presque épuisée de H +. et
permettant des ions de sodium de passer à travers.
Peut-être encore plus préoccupant est l'ammoniac. Dans un système avec de la chloramine dans l'eau du robinet, la résine DI servira l'importante fonction d'élimination de la majeure partie de l'ammoniac produit par la décomposition de la chloramine. L'ammoniac a une affinité plus faible pour de nombreuses résines de liaison aux cations que ne le font beaucoup d'autres cations (par exemple calcium ou magnésium). Par conséquent, lorsque la résine DI première est épuisée, un grand dégagement d'ammoniac à partir et à travers la résine DI est probable. J'ai eu récemment une résine DI s'appauvri, et l'effluent contenait tellement d'ammoniac que je pouvais facilement sentir.
Figure 11. Une résine DI, montrée prête à se lier à du dioxyde de carbone qui a dissocié
en H + et de bicarbonate (HCO 3 -).