Tampons (Biologie moléculaire)
1. Principes de base
La solution tampon de terme se réfère généralement à une solution qui minimise les variations de pH lorsque les ions hydrogène (H +, hydrons) sont ajoutés à la solution ou retirés de celui-ci. (Tel que discuté dans Référence1, IUPAC a approuvé Hydron pour désigner un cation d'hydrogène quand un terme indépendant de l'isotope d'hydrogène est souhaité.) Une telle solution est donc dit pour tamponner le pH. Les solutions peuvent également être conçus pour tamponner d'autres espèces, en particulier des ions métalliques, comme cela sera décrit ci-dessous.
Comme la concentration des ions d'hydrogène dans les milieux biologiques est faible, habituellement environ 0,1 | iM, il pourrait être considérablement modifié par la production ou la consommation de très faibles quantités d'ions d'hydrogène dans les réactions chimiques. Ce qui fait tampon généralement nécessaire dans les expériences en biologie moléculaire. Le principe d'un tampon est simple. Par rapport à la faible concentration d'ions hydrogène libres, le tampon consiste en concentrations beaucoup plus élevées à la fois une base, A "(à savoir, une substance qui peut se combiner de manière réversible avec les hydrons), et son acide conjugué, HA, qui est formée lorsque le la base se combine avec un Hydron. d'où l'équilibre
est établi. Par la suite, une addition de H + provoque une augmentation beaucoup plus faible dans sa concentration libre, [H +], parce que certains des hydrons sont utilisés en rendant plus HA pour déplacer cet équilibre vers la gauche. De même, toute baisse de [H +] est diminuée car elle conduit à la dissociation de HA.
2. Théorie simple
Les utilisateurs de tampons doivent être conscients de nombreuses caractéristiques de leur action si elles ne sont pas de faire des erreurs qui peuvent facilement ruiner leurs expériences. Pour cela, un peu de théorie des solutions tampons est nécessaire.
2.1. Dissociation de l'eau
L'eau se dissocie spontanément en un ion hydrogène et un ion hydroxyde:
le pH est de 7. L'échelle de pH est utile dans l'eau au cours de l'intervalle de 0 à 14, sur lequel varie [H +]
2.2. Le pKa et le pH
L'acide HA aura une constante de dissociation, Ka, la constante d'équilibre pour la réaction (1), qui est définie comme
Réorganiser ceci pour trouver [H +] donne
et en prenant le logarithme négatif de chaque côté pour trouver le pH [éq. (3)] donne
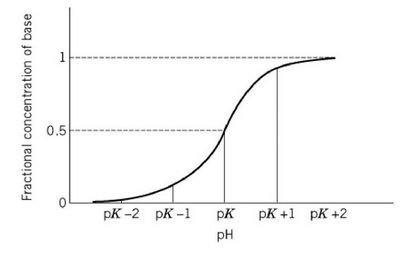
2.3. Théorie de tamponner
Avec les solutions tamponnées convenablement, à la fois [A-] et [HA] est beaucoup plus grande que [H +] et [OH-]. Dans ce cas, quelle que H + produite dans une réaction convertit A- dans HA, et tout H + repris dissocie de HA pour le convertir en A-. Pour voir les conséquences de cela, il convient de modifier l'équation de Henderson-Hasselbach comme suit:
3. Points pratiques
3.1. mesure du pH
Les méthodes de mesure du pH sont en dehors du champ d'application de cet article, mais le processus est important parce que la reproductibilité de la préparation du tampon dépend souvent (voir ci-dessous). La méthode la plus courante utilise une électrode en verre. Cette méthode dépend de l'immersion de l'électrode dans la solution à tester de telle manière qu'une cellule électrique est créé et que le potentiel donné par cette cellule dépend du pH de la solution. Normalement, une couche de verre mince sépare la solution en cours de test à partir de l'un contenant l'une des électrodes de la cellule. Ce verre est sélectivement perméable à hydrons, de sorte que le potentiel à travers elle dépend du pH de la solution. À condition que l'autre potentiel de jonction entre cette solution et l'autre électrode est négligeable, une condition approchée par un pont contenant KCl le potentiel concentré doit indiquer de façon fiable le pH.
3.2. Spécification d'une solution tampon
Les solutions tampons sont souvent spécifiées d'une manière classique, par exemple un tampon acétate de sodium 0,2 M, pH 4,8. La concentration donnée doit se référer à la somme des deux formes de l'espèce en mémoire tampon, désigné ici comme [AcO-] et [HOAc] dans le cas d'un tampon acétate, mais une telle spécification ne fait pas tout à fait clair comment cette solution a été obtenue . Il aurait pu être préparé par (1) le mélange des quantités appropriées d'acétate de sodium et l'acide acétique, tel que calculé à partir du pK et de l'équation de Henderson-Hasselbach, (2) l'addition d'acétate de sodium 0,2 M à l'acide acétique 0,2 M jusqu'à un pH de 4,9 a été atteint, ou (3) l'addition de NaOH solide à l'acide acétique 0,2 M, pour atteindre pH 4,9, en supposant que le volume ajouté de l'acide acétique dilué le négligeable. Il aurait été nécessaire, cependant, d'avoir ajouté du HCl solide à l'acétate de sodium 0,2-M, ce qui aurait produit de NaCl, en plus des espèces tampons.
pH mesure n'est pas simple, compte tenu notamment des effets de la température sur les mesures (voir ci-dessus); pour la reproductibilité, en particulier entre les différents laboratoires, il est beaucoup plus sûr de préciser la concentration de chaque forme de la substance tampon, étant donné que le matériel de pesage avec une précision de 1% à 2% est facile. Même une erreur de 2% dans chaque changerait le pH que par log (1.04), à savoir, par 0,017 d'une unité de pH. Par conséquent, il serait préférable de décrire le tampon vient de mentionner que l'acétate de sodium 0,12-M, acide acétique 0,08-M (pH 4,8), en ajoutant ainsi le pH pour obtenir des informations plutôt que dans le cadre de la définition.
3.3. Effets de la température
L'importance de cela doit être pris en compte dans chaque expérience. Si un utilisateur souhaite les résidus glutamate d'une enzyme à hydronated dans la même mesure dans une expérience à 0 ° C comme ils le seraient dans un tampon de pH 7 à 20 ° C, il serait erroné d'utiliser un tampon d'amino avec un pH de 7 à 20 ° C et simplement refroidir. Le refroidissement augmenterait le pH du tampon, mais pas le pKa des résidus, de sorte que ces résidus ne dissocie plus le refroidissement. Mais ce serait une bonne procédure si l'expérimentateur était préoccupé par l'état des résidus de lysine parce que leur pKa monterait à celle de l'amine tampon de sorte que leur degré de hydronation demeurerait le même.
3.4. Effets de la concentration
De nombreuses réactions chimiques sont catalysées par des acides ou des bases, de telle sorte qu'une concentration de tampon accrue peut les accélérer, même à un pH fixe. Il faut garder à l'esprit lors de la modification des concentrations de tampon. Il est très fréquent que les réactions catalysées par les enzymes parce que la sélection naturelle assure souvent que si une telle catalyse accélère la réaction, un groupe acide ou basique correspondant sera présente dans l'enzyme pour fournir.
3.5. buffers volatils
est déplacé vers la droite pour remplacer les formes non ionisées comme ils sont éliminés.
matériel biologique a généralement un pH proche de 7, et il est pas toujours facile de trouver une espèce de tampon avec le pKa désiré. Les acides carboxyliques possèdent des valeurs qui sont trop faibles, alors que les amines ont des valeurs trop élevées. Un grand nombre de tampons couramment utilisés sont des amines avec des substituants attirant les électrons, ce qui rend la paire d'électrons sur l'atome d'azote moins disponibles et ainsi réduisent pKa de l'atome. Les exemples comprennent:
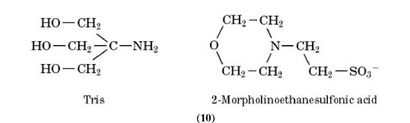
3.7. La nécessité d'buffers
Il faut se rappeler qu'il est inutile d'ajouter un tampon si les composants du mélange réactionnel sont déjà très en mémoire tampon. intermédiaires glycolytiques, par exemple, sont des esters de phosphate, et de les ajuster à un pH proche de 7 crée une solution tamponnée.
3.8. Réactivité chimique
peut produire environ 20 mM-cyanate (CNO-) à partir de 8 M d'urée (3). Le mal dans c'est la réaction inverse, car le cyanate peut carbamoylate résidus de lysine dans les protéines, formant des urées non chargées et de déstabiliser la protéine repliée. Ce processus est réduite au minimum si les ions ammonium sont présents dans le tampon comme ils sont en concurrence avec la protéine pour le cyanate.