Chimie 104 Synthèse de l'Aspirine
Chimie 104: Synthèse de AspirinINTRODUCTION
L'aspirine (acide acétylsalicylique) est un dérivé organique de l'acide salicylique synthétique. L'acide salicylique est un produit naturel présent dans l'écorce de l'arbre de saule et a été utilisé par les anciens Grecs et les Amérindiens, entre autres, contre la fièvre et la douleur. Cependant, l'acide salicylique est amer et irrite l'estomac.
Dans cette expérience, vous synthétiser l'aspirine (acide acétylsalicylique, C9 H8 O4), le purifier et déterminer le rendement pour cent. La pureté du produit est confirmée par une analyse qualitative et en mesurant sa gamme de point de fusion.
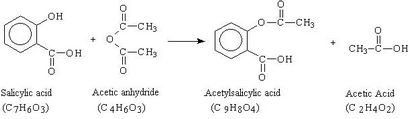
La réaction qui est utilisée pour la synthèse est représentée ci-dessous. Dans cette réaction, un excès d'anhydride acétique (C4 H6 O3) est ajouté à une masse mesurée de l'acide salicylique (C7 H6 O3) en présence d'un catalyseur, l'acide sulfurique (H2 SO4). Le mélange est chauffé pour former l'acide acétylsalicylique (C9 H8 O4) et de l'acide acétique (C2 H4 O2). Après que la réaction a lieu, l'eau est ajoutée pour détruire l'excès d'anhydride acétique et de provoquer la cristallisation du produit. L'aspirine est ensuite recueilli, purifié par recristallisation et sa température de fusion mesurée.
Utilisez-les uniquement dans le capot et assurez-vous que le ventilateur de la hotte est sur! Porter des gants lors de l'utilisation de ces produits chimiques. les produits chimiques en excès doivent être éliminés dans le bain d'eau en plastique. Ceci permet de convertir l'anhydride acétique du vinaigre et diluer l'acide sulfurique. Si vous renversez beaucoup de l'un de ces, informez votre instructeur.
PROCÉDURE DE SYNTHESE EXPERIMENTAL DE ASPIRIN
1. Enfilez votre CHEMICAL anti-éclaboussures LUNETTES DE SÉCURITÉ!
2. Ajout des matériaux de départ
A. L'utilisation d'un bateau de pesage. peser 5,00 g (+ 0,01 g) d'acide salicylique (C7 H6 O3). Transfert à un flacon Erlenmeyer de 125 ml en utilisant un entonnoir à poudre. Notez cette masse sur la fiche technique.
C. ajouter avec précaution 8 gouttes d'acide sulfurique concentré (18 M H2 SO4), un catalyseur, dans le ballon.
3. Chauffage Les matériaux de départ
A. A votre banc de laboratoire, assembler un bain d'eau chaude en utilisant un bécher de 600 ou 800 ml et placer le ballon dans le bain d'eau comme le montre la figure 1. Assurez-vous que le bain d'eau est situé sous le capot de votre banc de laboratoire.
B. Placer le flacon dans le bain d'eau et de la chaleur. Après que l'eau commence à bouillir, la chaleur pendant 15 minutes. (NOTE: Le bain d'eau chaude sera utilisée plus tard dans la procédure.)
4. refroidissement du mélange de réaction
A. Après chauffage, allumer le brûleur Bunsen et retirez ATTENTIVEMENT le flacon du bain d'eau (rappelez-vous qu'il est chaud!) Et laisser le ballon et son contenu refroidir sur le banc de laboratoire pendant environ 3 minutes.
C. Étiquette votre flacon contenant le mélange réactionnel et le placer dans un bain de glace et laisser refroidir jusqu'à ce que la cristallisation de l'aspirine apparaît complète (15 min environ..). Si les cristaux ne semblent pas, vous pouvez rayer les parois du flacon avec une tige d'agitation pour provoquer la cristallisation.
5. Le produit Isoler
A. Récupérer l'aspirine solide en utilisant un entonnoir de Buchner et du papier filtre comme représenté sur la figure 2. Assurez-vous de loger le papier filtre dans le filtre avec une petite quantité d'eau.
B. Rincer la fiole deux fois avec 3 ml d'eau glacée pour éliminer tous les cristaux résiduels.
C. Jeter le filtrat laissé dans le ballon de filtre dans le récipient à déchets sous le capot.
6. L'Aspirine recristalliser
A. Transfert autant du solide que possible de l'entonnoir Buchner à un endroit propre et sec bécher de 250 ml.
B. Ajouter 10 ml de 95% d'éthanol dans le bécher et le cas échéant, au chaud (ne pas faire bouillir!) Le mélange dans le bain d'eau pour dissoudre les cristaux. Si les cristaux ne se dissolvent pas tous, ajouter 2 ml plus de l'éthanol et de continuer à chauffer le mélange pour dissoudre les cristaux.
C. Lorsque les cristaux sont dissous tous, ajouter 10 ml d'eau déminéralisée, couvrir le bécher avec un verre de montre. et laisser la solution refroidir lentement sur le banc de laboratoire non perturbé pendant environ 10 minutes.
D. Après les 10 minutes de refroidissement sur le banc de laboratoire, compléter la cristallisation en plaçant le bécher et son contenu dans le bain de glace. (LABEL votre bécher!) Doivent former des cristaux. Si une « huile » apparaît à la place d'un solide, réchauffer le bol dans le bain d'eau chaude jusqu'à ce que l'huile disparaît. Si les cristaux ne semblent pas, vous pouvez rayer le fond du récipient avec une tige d'agitation pour provoquer la cristallisation.
7. Séchage Le Purifié Aspirine
A. Utilisation d'un cercle de papier propre du filtre, recueille l'aspirine a été purifié par filtration sous vide comme précédemment.
B. Sécher les cristaux en tirant l'air à travers eux pendant environ 15 minutes. (Jeter le filtrat laissé dans le ballon de filtre dans le récipient à déchets sous le capot. Rincer la fiole de filtration avec de l'eau et jeter l'eau de rinçage dans le récipient à déchets sous le capot).
C. Placer l'aspirine sur un morceau doublé de serviette en papier et laisser sécher tout en effectuant l'analyse qualitative de l'aspirine. (Laver l'entonnoir de filtration avec de l'eau et jeter l'eau de rinçage dans le récipient à déchets sous le capot).
8. L'analyse de l'Aspirine Qualité
A. La présence de l'acide salicylique qui n'a pas réagi dans l'aspirine synthétisée peut être détectée avec le fer (III) d'essai de chlorure.
1. Ajouter environ 1 ml d'eau déminéralisée à cinq tubes à essai propres de 10 cm. L'utilisation d'un agitateur propre, placer un cristal d'acide salicylique dans le premier tube à essai. Dans le second, placez un cristal de l'aspirine commerciale en poudre, et dans le troisième, placez un cristal de votre aspirine synthétisée. Le tube de test selon le contrôle.
2. Pour chaque tube d'essai, ajoutez 1 goutte de solution de fer (III) de chlorure). Secouez chaque tube à essai et observer les couleurs produites. Enregistrez vos observations et conclusions sur la fiche de données.
B. Mesurer la plage de point de fusion de votre aspirine synthétisée avec l'appareil Meltemp comme démontré par votre moniteur de laboratoire et comparer à la valeur de l'aspirine pure de 138-140 ° C Noter la température de fusion sur la feuille de données.
9. Calcul du rendement en pourcentage de Aspirine
A. Peser l'aspirine et de calculer le rendement théorique (maximum). [Remarque: l'anhydride acétique est en excès et l'acide salicylique est le réactif limitant. Utilisation de l'acide salicylique pour le calcul du rendement théorique.]
B. Sur la base de votre rendement pour cent, test de chlorure de fer (III), et la plage de point de fusion mesuré, tirer une conclusion sur la réussite de votre synthèse.
C. Placez votre aspirine dans le pot intitulé « Préparation des élèves Aspirine ».
Chimie 104: Synthèse de l'Aspirine